�u���O�@���w�ƊE�̘b��@ knak�̃f�[�^�x�[�X����
�@�@�@ �@�@�ڎ�
����͉��L�̃u���O�������Ƃɂ܂Ƃ߂����̂ł��B
�ŐV���� �@ https://blog.knak.jp
�@
�@
2025/12/1 ����`����A�m�[�x����܂̍���E����w���C�����Ƌ��������ŊJ�����̂��Ö�A2029�N�ɂ����F�\��
����`����͍��N�̃m�[�x�������w�E��w�܂̎�܂����܂�������w�E����u�����C�����Ƃ̋��������ŊJ�����̂��Ö�
��2029�N�ɂ����Ăŏ��F�\������B
�[�[�[
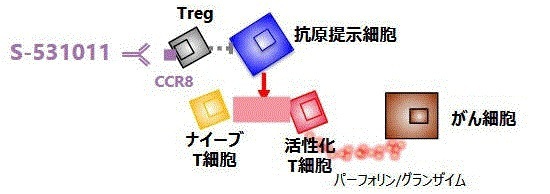
��������� ���B�ō����uT�זE �v�Ƃ��������p���̒��ɁA���Ȃ̑g�D�ւ̍U����}����������������^�C�v�����݂���Ɛ������A�������n�߂��B �T���̌��ʁA�uCD25 �v�Ƃ�������ς�����\�ʂɎ������p�����A�}�E�X�̑̓��ł��������������ʂ����Ă���Ɠ˂��~�߁A1995�N�ɘ_�����\�����B��Ɂu���䐫T�זE �v�i Regulatory
T cell �FTreg �j �Ɩ��t���A�q�g�ɂ����݂��邱�Ƃ����������B
�@�@�@�@2025/10/7�@2025�N�̃m�[�x�������w�E��w�� �@
����`����́A2014�N�ɑ���w�̍Ő�[��ÃC�m�x�[�V�����Z���^�[���ɋ��������u�����J�݂��A��������̎w���̂��ƁA��ᇖƉu�����Treg�Ɋւ����i�I�Ȍ����𐄐i���Ă����B
���̉ߒ��ŁA2018�N�Ɏ�ᇐZ�����䐫T�זE�ɓ��ٓI�ɔ������镪�q�Ƃ���CCR8��V���ɓ��肵�i���������ρj�A���̐��ʂ���Ղ�CCR8��W�I�Ƃ����R�̈��uS-531011�i�RCCR8�R�́j�v�̂���̈�ł�Phase
1b/2�������s�Ӑi�߂Ă���B
S-531011 �̊T�v�A�@�\�͉��L�̒ʂ�ŁA�Ɖu�זE�̊������R���g���[������u���䐫T�זE�v �i Regulatory
T cell �FTreg �j ����菜���A�Ɖu�זE��������U������͂����߂�B
�܂��咰�����ΏۂƂ��A�����͑��̂���ɂ��L����
�i�݂����H������Ȃ�12��ނ̌Ō`����Ɍ��ʂ������߂�\��������j�B���̍R���܂Ƃ̕��p�ȂǁA�ł����ʂ������Ȃ铊�^������T���Ă���B
���Ö���u5�N�Ŏ��p�����������v�Ƃ��Ă���B
�@�E���i�����F�RCCR8
�q�g�����m�N���[�i���R�̂ŁA���S���ɗD��A��ᇖƉu�������邱�Ƃŋ�����������ҁB�l�X�Ȋ��킪�K���ƂȂ�\��������B
�@�E��p�@���F��ᇓ��̐��䐫T�זE�iTreg�j�ɑI��I�ɍ��������Ă���CCR8
�Ɍ������A�זE���Ə������邱�ƂŖƉu�}������������B��ᇖƉu�����A�R��ᇌ��ʂ�����B
�@�@�@�@�@�@���}�̂Ƃ���ATreg����������邱�ƂŁA�i�C�[�uT�זE�i����������Ԃ�T�זE�j������������A�p�t�H�[�����ƃO�����U�C�������זE��j��B
�@�p�[�t�H�����ƃO�����U�C���́A
�זE���Q��T�זE�iCTL�j��i�`�������L���[�iNK�j�זE�����A����זE��E�C���X�����זE���U�����邽�߂̃^���p�N�� �B
�@�@�@�@�@�@�@�@�@�@�[�[�[
���䐫T�זE�iTreg�j�͐l�Ԃ̑̓��ɂ����āA�ߏ�ȖƉu������}���钲���E�u���[�L���Ƃ��ċ@�\������̂ł���A����Treg�𑝂₵���菜�������肷�邱�Ƃŕa�C�������V���n�낤�ƁA���E�̐����ЂŌ������i�߂��Ă���B
���O����͑���w�Ɖu�w�t�����e�B�A�����Z���^�[�Ƌ��������ŁATreg�ŏd�v�Ȗ��������uFoxP3�v�Ƃ����^���p�N���𐧌䂷��V���Ȃ����݂����A���ȖƉu���������Â���\���������������B
����A ����u�����C�����Ƌ����Ńm�[�x�������w�E��w�܂�����Institute
for Systems Biology��Mary E. Brunkow�A��Sonoma
Biotherapeutics��Fred Ramsdell
�����m��2001�N�A���ȖƉu�������N�����Ă���}�E�X�ƃq�g�ŁAFOXP3 �Ƃ�����`�q�ɕψق����邱�Ƃ�����
�A���̌�A���������FOXP�����䐫T�זE�ɂ����ďd�v�Ȗ������ʂ����Ă��邱�Ƃ�˂��~�߂��B
�A�X�e���X��������������Ƃ̌����O���[�v�ŁATreg��U�������ǂ�}���鉻���������Ă���B
��ː���ƕč��q��Ђ�Otsuka Pharmaceutical
Development & Commercialization, Inc.��11��25���A���Ђ�VOYXACT® �i��ʖ��F�V�x�v�������}�u�j���A"�i�s���X�N�̂��鐬�l��IgA�t�� �ɂ������^���p�N�A�̌��� "�̌��\�ŁA�č�FDA���v�����F���擾�����Ɣ��\�����B
�{�܂͏����[�U�[�t�B�[�@�iPrescription
Drug User Fee Act �j�ɂ��D��R�����F�߂��Ă����B�i�����Ƃ��V��̏��F�R������ۂɁAFDA�Ɏ萔�����x�������Ƃ��`���t�����@���ŁA���̖@���ɂ��AFDA�͐R����p��d���A�R���̐����������邱�ƂŁA�V��̏��F�R����v��������B�j
IgA�t�ǂ́A�i�s���̎��ȖƉu�������t���a�ł���A20�`40�̐��l�ɔ��ǂ���ꍇ�������B���݂̕W�����Âł͑����̊��҂����U�̂����ɖ����t�s�S�Ɏ���\��������B
�^���p�N�A�̌��� ���t�@�\�����x�� �Ƒ��ւ����փ}�[�J�[�ł���A�{�܂̗Տ������ɂ����Đv�����F���x�������v�ȃG���h�|�C���g�Ƃ��ėp����ꂽ�B51.2%�L�ӂɌ��� �������B���S���̓v���Z�{�Ɠ����ł���A�ǍD�ȔE�e�����m�F����Ă���B
�����I�ɐt�@�\�̒ቺ��}�����邩�ǂ����́A�܂��m������Ă��Ȃ��B
VOYXACT�͎��ȓ��^���\�Ȕ牺���^�̃v���t�B���h�V�����W���܂ŁA���҂�4�T�Ԃ��Ƃɍݑ�^�ł��闘��������B
VOYXACT �i�V�x�v�������}�u�j�́A��ː���̎q��Ђł��� Visterra
Inc. ���n�����AIgA
�t�ǂ̔��Nj@���Ɋ֗^���Ă���APRIL�iA-Proliferation-Inducing Ligand�F���B�U�����K���h
�j�ɑI��I�Ɍ������邱�Ƃł��̊�����j�Q���郂�m�N���[�i���R�̂ł���B
�[�[�[
Otsuka America ��2018�N7���� ����430�S���ăh�� ��Visterra
Inc.�������B
���̊����TOP5 �͉��L�̒ʂ�ŁABill and
Melinda Gates Foundation��A�V���K�|�[�����{�̓������Temasek ���܂܂�Ă���B
Polaris
Partners 17.2%
Flagship
Pioneering 15.3%
Bill and
Melinda Gates Foundation 10.6%
Merck
Research Lab Venture Fund 10.2%
Temasek
Holdings 10.2%
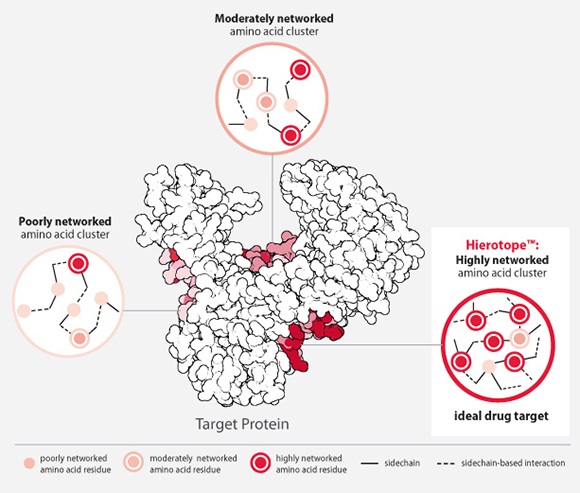
Visterra�́A�^���p�N���̋@�\�ɕK�{�ƍl�����镔���̗��̍\�����R���s���[�^�[��Ő��肵�A�������R���s���[�^�[��Ő��肵�������̍R�̂̕����\���ƌ����V�~�����[�V�������s���A�œK�ȍR�̍\�������A�R�̈���v����Ǝ��̍R�̃v���b�g�t�H�[���Z�p�iHierotope
platform�j��L������B
����ɂ��A�]������ƍl�����Ă��������̐��̕����ɑ���R�̈��i���J���ł���\��������B
�@
���B�ψ����12��5���A�f�W�^���T�[�r�X�@
(Degital Seevices Act : DSA) �Ɋ�Â��������`���Ɉᔽ�����Ƃ��āAElon Musk ��
SNS�v���b�g�t�H�[���uX�v�i��Twitter) �ɑ���1��2000�����[���̔������Ȃ����B
�f�W�^���T�[�r�X�@�́ASNS�Ȃǂ̃I�����C���v���b�g�t�H�[���ɑ��A ��@�E�L�Q�R���e���c�i�U���A�w�C�g�X�s�[�`�Ȃǁj�̍폜�A�L���̓������m�ہA���p�ҕی� ���`���t����EU���ꃋ�[���ŁA2022�N11��16���ɔ����A 2024�N2���ɑS�ʎ{�s ���ꂽ�B�ᔽ��Ƃɂ͋��z�̐��ً��i�ő�@�N�Ԕ��㍂��6% �j���Ȃ����B
�ړI :
�I�����C�����ł̈��S�m�ہA�U����A����҂̊�{�I�l���ی�A�����ȃf�W�^����Ԃ̑n�o
�`�� :
��@�R���e���c�̐v���ȍ폜�E�Ή�
�L���̃^�[�Q�e�B���O���i�N���L�����o���Ă��邩�j�̊J��
�u���R�����f�[�V�����i�������ߕ\���j�v�̎d�g�݂̓�����
�����҂ɂ��f�[�^�A�N�Z�X�ւ̋���
���X�N�]���Ƒ�̎��{�i���ɑ�K�̓v���b�g�t�H�[���j
�Q�l�F �����ȁ@ EU
DSA�@�iDigital Services Act�j�̊T�� �i�쑺�����������쐬�j
�@
2023�N12��18���A�ψ���́A��@�ȃR���e���c�̊g�U����я��ɑR���邽�߂ɍu����ꂽ�[�u�̗L�����Ɋ֘A���镪��ɂ����āAX���f�W�^���T�[�r�X�@�Ɉᔽ�����\�������邩�ǂ�����]�����邽�߂̐����Ȏ葱���J�n�����B
X�͍���̒����ŁAEU�ŐV�����{�s���ꂽ�f�W�^���T�[�r�X�@�iDSA�j�̈ᔽ�̋^��������Ƃ��Đ����Ȓ������鏉�̎�v�ȃv���b�g�t�H�[���ƂȂ����B
�ᔽ�s�ׂɂ́A1)
�u�u���[�`�F�b�N�}�[�N�v�i ���o�b�W�j �̌���������v�A2)
�L�����|�W�g���̓������̌��@�A����� 3)
�����҂����J�f�[�^�ւ̃A�N�Z�X����Ȃ��������Ƃ��܂܂��B
�@
1)
�u�u���[�`�F�b�N�}�[�N�v�̌���������v
Blue Checkmark�́A SNS���A���̃A�J�E���g�� �����܂��͖{�l�ł��� ���Ƃ������F�o�b�W
�ŁA�A�J�E���g�̐M������{ ���ł��邱�Ƃ��ؖ����A�Ȃ肷�܂���h������������B
X���u�F�؍ς݃A�J�E���g�v��Blue
Checkmark���g�p�������Ƃ́A���[�U�[���\���B
����́A�I�����C���v���b�g�t�H�[��������T�[�r�X�ɂ������\�ԓI�ȃf�U�C�����s���֎~ ����Ƃ����f�W�^���T�[�r�X�@�̋`���Ɉᔽ���Ă���BX�ł́A�A�J�E���g�̔w��ɂ���l������Ђ��L�Ӌ`�Ɋm�F���邱�ƂȂ��u���؍ς݁v�X�e�[�^�X���擾���邽�߂ɒN�ł��x�������\�ł���A���[�U�[���A�J�E���g��R���e���c�̐^�����f����͍̂���ɂȂ�B���̍��\�́A���[�U�[���U�����\���܂ލ��\��A���ӂ̂���s�҂ɂ�鑼�̌`�̑���ɂ��炷�B�F�؍ς݂ł���Ƌ��U�Ɏ咣���邱�Ƃm�ɋ� �~���Ă���B
X�ł� 2023�N4���ȍ~�A�]���̒����l�����F�͏I�����A�N�ł��������āi�����t���Łj Blue
Checkmark ���l���ł���悤�ɂȂ����B �����l�łȂ��Ă��A�N�ł����������Ύ擾�\�ɂȂ����B
Elon Musk
�̔����ȑO��Twitter�̏]����Blue Checkmark �̎�ȓ����F
�M�ߐ��̏ؖ� :
�Ȃ肷�܂���p���f�B�A�J�E���g�ƁA�����l�A�W���[�i���X�g�A�����ƁA��ƂȂǂ̌����ȃA�J�E���g����ʂ��邱�Ƃ�ړI�Ƃ��Ă����B
��̌��i�� :
�o�b�W�́ATwitter�Ђ��Ǝ��ɐݒ肵���u�����ŁA�����ŁA�M���ł���v�Ƃ�����Ɋ�Â��āA�R�����o�ĕt�^����Ă����B�N�ł��\���ł������A�K���t�^�����킯�ł͂Ȃ������B
���� :
���݂̂悤�Ɍ��z�������x�����Ď擾������̂ł͂Ȃ��A��������A�J�E���g�ɖ����Œ���Ă����B
�X�e�[�^�X�V���{�� :
���L������������߁A���̃X�e�[�^�X�V���{����Љ�I�M�p�������}�[�N�Ƃ��ĔF������Ă����B
Elon
Musk�ɂ�锃����A�]���̔F�v���O�����͔p�~����ABlue Checkmark��X
Premium�T�u�X�N���v�V�����̉����҂ɕt�^�������̂ɕύX���ꂽ�B
�����A���݂� Blue
Checkmark�́A�Ώۂ̃A�J�E���g��X
Premium�̃A�N�e�B�u�ȃT�u�X�N���v�V���� ��ۗL���Ă���A����̎��i������Ă��邱�Ƃ��Ӗ�����B
X�v���~�A���ɂ́u�x�[�V�b�N�v�A�u�v���~�A���v�A�u�v���~�A���v���X�v��3�̃T�u�X�N���v�V�������x��������A���x���������Ȃ�قǁA��葽���̋@�\�𗘗p�ł���B
X�v���~�A���́A�ȉ��̊�����Ă���K�v������B
���ɕs�����Ȃ�����: �Ώۂ̃A�J�E���g�ɂ͕\�����ƃv���t�B�[���摜���ݒ肳��Ă���K�v������B
�A�N�e�B�u�ɗ��p����Ă��邱��: X�v���~�A���ɃT�u�X�N���C�u����ɂ́A�Ώۂ̃A�J�E���g���ߋ�30���Ԃɂ킽���ăA�N�e�B�u�ł���K�v������B �Z�L�����e�B:
�F�ؑΏۂ̃A�J�E���g�ɂ́A�m�F�ς݂̓d�b�ԍ����o�^����Ă���K�v������B
�\�ԓI�s�ׂɉ��S���Ă��Ȃ�����
�Q�j X�̍L�����|�W�g���i�L���L�����y�[���Ŏg�p���� �摜�E����E�e�L�X�g�E�f�U�C���e���v���[�g�Ȃǂ̃f�W�^�����Y���ꌳ�I�ɕۑ��E�Ǘ�����f�[�^�x�[�X��V�X�e���j�� �������̌��@
X�̍L�����|�W�g���́A�f�W�^���T�[�r�X�@�̓���������уA�N�Z�V�r���e�B�v�������Ă��Ȃ��B���p�\�Ō����\�ȍL�����|�W�g���́A�����҂�s���Љ���\�A�n�C�u���b�h���ЃL�����y�[���A�A�g�������A����ыU�̍L�������o���邽�߂ɋɂ߂ďd�v��
����B
X�͐v�@�\��A�N�Z�X��ǂ�g�ݍ���ł���A���Ƃ��Ώ������x������ȂǁA�L�����|�W�g���̖ړI�Ȃ��B
3)
�����҂����J�f�[�^�ւ̃A�N�Z�X����Ȃ���������
X�́A�����҂��v���b�g�t�H�[���̌��J�f�[�^�ɃA�N�Z�X�ł���悤�ɂ���Ƃ����f�W�^���T�[�r�X�@�̋`�����ʂ����Ă��Ȃ��B
���Ƃ��AX�̗��p�K��ł́A�ΏۂƂȂ錤���҂��X�N���C�s���O�i Web�T�C�g����v���O�������g���ĕK�v�ȏ��������I�Ɏ��W�E���o�E���`����Z�p�j �Ȃǂ�ʂ��Ď���̌��J�f�[�^�ɓƗ����ăA�N�Z�X���邱�Ƃ��֎~���Ă�
��B
����̓f�W�^���T�[�r�X�@�Ɋ�Â����߂ẴR���v���C�A���X�ᔽ�̌���ł���B
X�́ABlue
Checkmark��s���Ɏg�p�������ƂɋN������N�Q���I�������邽�߂ɍu�����̓I�ȑ[�u�ɂ��āA�ψ���ɒʒm���邽�߂�60�c�Ɠ��̗P�\���Ԃ����ݐ݂��Ă�
��B
X�́A�L�����|�W�g������ь����҂̌��J�f�[�^�ւ̃A�N�Z�X�Ɋւ���N�Q�ɑΏ����邽�߂ɕK�v�ȑ[�u���߂��s���v����ψ���ɒ�o���邽�߂�90�c�Ɠ��̗P�\���Ԃ�L����B
�R���v���C�A���X�ᔽ�̌���ɏ]��Ȃ��ꍇ�A����I�Ȕ����̎x�����ɂȂ���\������
��B
�@
Elom Musc�͓����AEU�����ً����Ȃ����Ƃɔ��������BX�̓��e�ŁAEU���uX�����łȂ����l�ɂ��������������Ȃ������Ƃ͂���ɋ����Ă���v�ƋL�����B
�Đ����̊t��������AEU�̃f�W�^���K�����ăe�b�N��Ƃ�W�I�ɂ��Ă���Ƃ��āA�ᔻ�����������B
�@
����܂ł̑�\�I�Ȕ�����
1.
Meta (Facebook)
2.
Google
3.
Amazon
4.
Apple
5.
TikTok
6.
Twitter
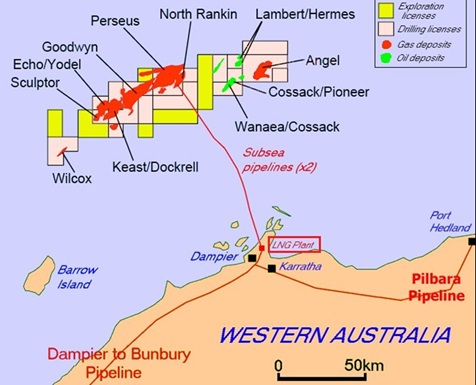
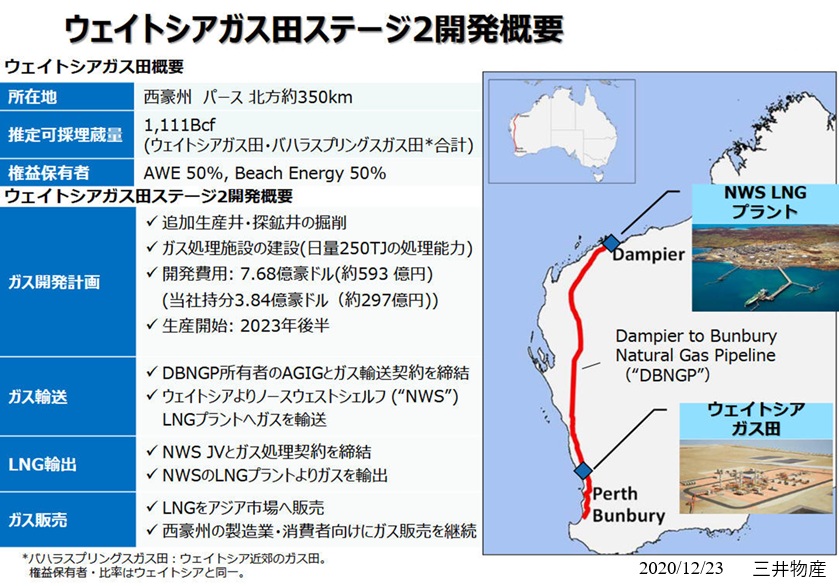
2025/12/15�@�O�䕨�Y�A���B��LNG��V�K���Y�@
�O�䕨�Y�͋߂����B��LNG�̐V�K���Y���n�߂�B
���B�쐼���� Waitsia
�K�X�c�R����LNG�ŁA���v�x�[�X�ŔN70���g�����x�̐��Y�������ށB
�O�䕨�Y��2023�N12���A�O�䕨�Y100%�q��Ђ�AWE
Pty Ltd ��ʂ���50%���v��ۗL���I�y���[�^�[�߂鐼���BWaitsia�K�X�c�̖{�i�I���ƊJ���ɂ��A���ƃp�[�g�i�[��Beach
Energy Limited�Ƌ��ɁA�K�v�Ȑ��{���F�擾��O��Ƃ����ŏI�������f���s�����B
���Ђ�2018�N�ɁA�����B�p�[�X�̖k��350km�̗���ɂ���Waitsia�K�X�c�̌��v��ۗL����AWE
Pty Ltd�������B
2018/2/9
�O�䕨�Y�A���Ζ��K�X��蔃��
Waitsia�K�X�c�́A���B�ő勉�̗���V�R�K�X�c��AWE��Beach
Energy��50%�����v��L����B
�O�䕨�Y��AWE������ɁA�O�䕨�Y���Q�悷��North
West Shelf JV
�̓V�R�K�X�t���ݔ���ʂ���LNG�s��ւ̃A�N�Z�X���m�ۂ������Ƃ���A���Ɖ����i�̔��f�Ɏ������B
North West
Shelf JV�� BHP
Billiton�AWoodside Energy�ABP�AChevron�AShell�AJapan
Australia LNG�i�ʏ�
MIMI�j��6�Ђ��ϓ��o�����AWoodside ���^�c��S������B
MIMI�ЊT�v
���� Japan Australia LNG (MIMI) Pty., Ltd
�ݗ��N 1985�N
���{�\�� �O�䕨�Y50%�A�O�H����50%
���ƊT�v �K�X�E�Ζ��̒T�z�A�J���A���Y�A�K�X�t���A�A���y�є̔�
���ݒn ���I�[�X�g�����A�B�p�[�X
2022�N6����BHP
��Woodside ���������A���ꂪ1/3�����L�A����4�Ђ�1/6�����L����B
�������Y�v���b�g�t�H�[���ł̐Ζ��i��ɓV�R�K�X�ƃR���f���Z�[�g�j�̍̌@�AKarratha�K�X�v�����g�ł̗��㏈���A�B���̎Y�Ɨp�A���Ɨp�A�ƒ�p�̓V�R�K�X���Y�A����щt���V�R�K�X�̗A�o���܂܂��B
�@
Waitsia�v���W�F�N�g�́A���E�Ŏ��v�̑����������܂��LNG�̈��苟���ɍv������ƂƂ��ɁA�����B�̐����Ƃ����Ҍ����ɍ����K�X�̋������p�����邱�Ƃ�\�肵�Ă���B�܂��A�����I�ɃK�X�ւ̔R���]���𑣐i���A��Y�f�Љ�̎����ɍv��������g�݂ɂȂ�B
Waitsia
�̃X�e�[�W2�J���ł́A�����̓���20�e���W���[���̐��Y�\�͂ɉ����āA����250�e���W���[���̐��Y�\�͂�V�݂���B��̓I�ɂ́A�lj����Y��̌@��ƐV�K�K�X�����{�݂̌��݂�\�肵�Ă���A�������z�̓v���W�F�N�g100%�x�[�X��7.68�����h���i��593���~�j��\�肵�Ă���B
Waitsia JV��NWS
JV�Ƃ̊ԂŃK�X�����_���������A�K�X���t�����A�o���邽�߂ɕK�v�ƂȂ�ݔ��̗��p�����m�ۂ��Ă���B
�@
2025/12/31 ���R��w�A�H������ɑ����ᇗn���E�C���X���܁u�e�������C�V���v�̈��i�����̔����F��\��
�e�������C�V���iTelomelysin�AOBP-301�ASuratadenoturev�j�́A���R��w�ŊJ�����ꂽ���Y���R����E�C���X���� �ŁA������������זE���E�� ����ƂƂ��ɕ��ː��ɑ��銴�����邱�Ƃ����炩�ƂȂ��Ă���B
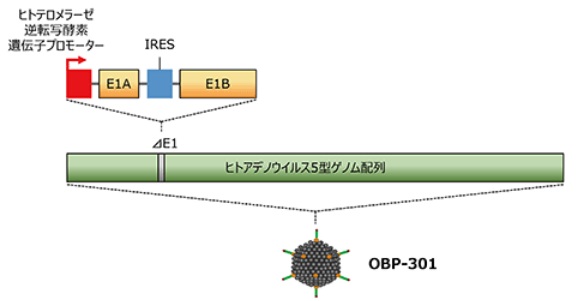
�e�������C�V���́A���׃E�C���X�̈��̃A�f�m�E�C���X �i5�^�j��
E1
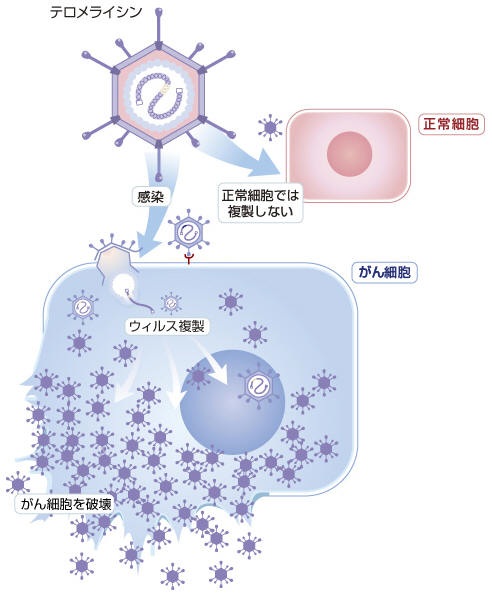
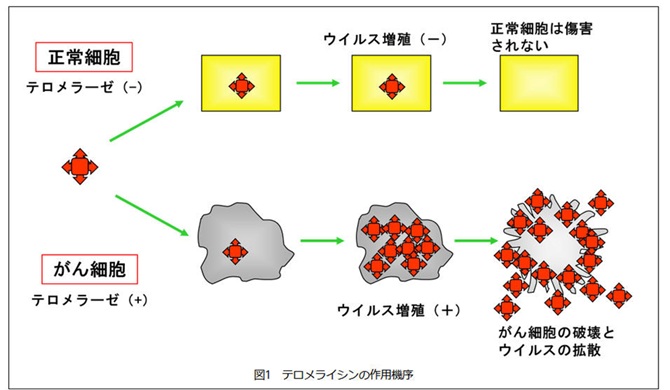
�̈�ɁA�����̂���זE�Ŋ������㏸���Ă���e�������[�[�Ƃ����y�f�̃v�����[�^�[����`�q���ςɂ���đg���݁A����זE���œ��ٓI�ɑ��B���Ă���זE��j�邱�Ƃ��ł���悤�ɂ����E�C���X���܁B
5�^�̃A�f�m�E�C���X���͕̂��ׂ̏Ǐ�������N�������̂ŁA���R�E�̋�C���ɂ����݂���B�e�������C�V���́A�e�������[�[�����̍�������זE�œ��ٓI�ɑ��B���邱�Ƃ�����זE��n�������鋭���R��ᇊ��� �������B
�e�������C�V�����q�g�̂���זE�Ɋ�������ƈ���� 10 ���`100
���{�ɑ����A����זE��j��B
����ȍזE�̒��ł̓e�������[�[�������Ⴍ�e�������C�V��® �̑��B�\�͂��ɂ߂ĒႢ���߁A�Տ��I�Ȉ��S����ۂ��Ƃ����҂���Ă���B
�@
�̂̕��S�����Ȃ��A����܂Śq�f�E�E�сE�������Q�Ȃǂ̏d�Ăȕ���p�͕���Ă��Ȃ����Ƃ���A���҂�QOL�iQuality of
Life�j�̌��オ���҂����B
�e�������C�V���́A���ː����Â≻�w�Ö@�܂Ƃ̕��p�ɂ��A�X�ɋ��͂ȍR��ᇊ����������o���邱�Ƃ����炩�ɂȂ��Ă���B
�e�������C�V�������ː��ɂ�邪��זE��DNA
�����̏C����j�Q ���A���ː����Â̊����i�i�ɑ������邱�Ƃ��ł���B���ٓI�ȍR���̃V�O�i��������זE���̖Ɖu�זE�ɒ��ړ`���� ���Ƃɂ��A����Ɖu��U���ł��邱�Ƃ���������Ă���A�RPD-1
�R�̓��̖Ɖu�`�F�b�N�|�C���g�j�Q�܂Ƃ̕��p�ɂ��A�S�g�I�ȍR�����p�����҂���Ă���B
�@
�Ώێ����́A�H������A�݁E�ݐH���ڍ�������A�̑�����Ȃǂ̌Ō`����ŁA����A�H������p�ɂ��ď��F�\�����s�������A�݂���A�̑�����ɂ��Ă��J����i�߂Ă���B
�Ȃ��A�����ɂ��ẮA���{�̂ق��A���L�̏����Ŏ擾���Ă���B
�č��A���B�i14�J���j�A��A�A�V���K�|�[���A�j���[�W�[�����h�A�I�[�X�g�����A�A�����A���`�A�؍��A�J�i�_�B
�[�[�[
���R��w�ŊJ�����ꂽ�e�������C�V���̗Տ������́A2006
�N����č��H�i���i�ǁiFDA�j�̏��F�̂��ƁA�č��ł̈��S�����m�F����� I ���Տ���������n�܂����B
���̌�A��b�����Ńe�������C�V�������ː����Â̌��ʂ����߂錻�ۂ����炩�ƂȂ�A2013
�N����͉��R��w�ŊO�Ȏ�p��R������ÂȂǂ̕W�����Â��ł��Ȃ��H�����҂Ƀe�������C�V���ƕ��ː����Âp����Տ����������{�����B
�܂� 2017
�N����́A���R��w�ƍ��������Z���^�[���a�@�œ��l�̃v���g�R�[���ŃI���R���X�o�C�I�t�@�[�}���� I ����Ǝ������s���A2020
�N����͉��R��w�a�@���܂ސH�����Ẫn�C�{�����[���Z���^�[�i�S�� 17 �{�݁j�ł̑��{�����ő� II ����Ǝ��������{�����B�W�����Â�����H������ �ɑ����ᇗn���E�C���X���܁u�e�������C�V���v�̈��i�����̔����F�\�����s��ꂽ�B
�e�������C�V���́A2019
�N�Ɉ��i��Ë@�푍���@�\�iPMDA�j�ɂ��v���R��������u��삯�R���w�萧�x�v�̑Ώەi�ڂɎw�肳��Ă���A����APMDA
�ɂ��R��������A���J�Ȃ̖R�c��̕���ŐR�c����A�����ʂ�\���� 6 �����قǂŐ����̔����F�Ɏ��邱�Ƃ�������ł���B
�e�������C�V���̔̔��́A�I���R���X�o�C�I�t�@�[�}�Ɣ̔���g�_�����������ł���x�m�t�C�����x�R���w���s���\��B
�[�[�[
�I���R���X�o�C�I�t�@�[�}�́A2004�N3���� ��ᇗn���E�C���X�̌����J���y�ѕ��q�W�I�R��ᇖ�̌����J����ړI�ɐݗ����ꂽ�B�����،�������O���[�X�s��ɏ�ꂵ�Ă���B
�E�C���X�w�ɗ��r�����Z�p����g���āA�����d�NJ����ǂ̎��Ö@�ɃC�m�x�[�V�������N�����A���E�̈�Âɍv�����邱�Ƃ��g���Ƃ��Ă���B
�E�C���X�̑��B�\�͂𗘗p���Ă�����E���u����̃E�C���X�Ö@�v�ƁA�E�C���X�̑��B��}�����Ď��Âɍv������u�d�ǃE�C���X�����ǎ��Ö�v�����Ɨ̈�Ƃ��C�E�C���X�����ɂ����w�E�C���X�n��x��W�J���Ă���B
���ɂ���̈�ł́A�u�����炸�Ɏ��Â���v�Ƃ����R���Z�v�g�Ɋ�Â��A����̃E�C���X�Ö@�e�������C�V���i OBP-301�j���͂��߂Ƃ����ᇗn���E�C���X�̊J�����s���Ă���B����ɁA����̋Ǐ����Â݂̂Ȃ炸�A�S�g�֓]�ڂ�������̎��Â��\�Ƃ��邽�߁A�Ɖu�`�F�b�N�|�C���g�j�Q�܂⑼�̎��Ö@�Ƃ̕��p�Ɋւ���J���𐄐i���Ă���B
����́A�����d�NJ����Ǘ̈�ɗ��܂炸�A�I�[�t�@���h���b�O�i���a�p���i�j�̈�ɂ��g�債�A��a���ÂɊ�^���邱�Ƃ�ڎw���B
OBP-301�̏�s�ɔ������Ў��g�������ЂɂȂ邱�ƂŁC���i�̊J���g�����h���萻���Ђ̐헪�ɍ��E����郉�C�Z���X�����Ɉˑ������r�W�l�X���f������E�p���C�u�p���������i�̐��i�̔������������鐻���Ќ^���ƃ��f���v�Ɓu���C�Z���X��̃C�x���g�B���ɂ��}�C���X�g�[�������Ȃǂ郉�C�Z���X�^���ƃ��f���v�̃n�C�u���b�h���f���֕ϊv�����Ă������j�B
�@
�@
�@
�@
�@
�@