Illuminating Biology
The discoveries awarded
the 2008 Nobel Prize in Chemistry are a shining example of how
fundamental research in one area of science can sometimes lead to
highly beneficial applications in another. In this case, finding
the key to how a marine organism produces light unexpectedly
ended-up providing researchers with a powerful array of tools
with which to visualize cell biology in action.
The story begins with
Osamu Shimomura's research into the phenomenon of
bioluminescence, in which chemical reactions within living
organisms give off light. While studying a glowing jellyfish in
the early 1960s he isolated a bioluminescent protein that gave
off blue light. But the jellyfish glowed green. Further studies
revealed that the protein's blue light was absorbed by a second
jellyfish protein, later called green fluorescent protein (GFP),
which in turn re-emitted green light. The ability of GFP to
process blue light to green (its fluorescence) was found to be
integral to its structure, occurring without the need for any
accompanying factors.
In 1988, Martin Chalfie
heard about GFP for the first time, and realized that its ability
for independent fluorescence could perhaps make it an ideal
cellular beacon for the model organisms he studied. Using
molecular biological techniques, Chalfie succeeded in introducing
the gene for GFP into the DNA of the small, almost transparent
worm C. elegans. GFP was produced by the cells, giving off its
green glow without the need for the addition of any extra
components, and without any indication of causing damage to the
worms. Subsequent work showed that it was possible to fuse the
gene for GFP to genes for other proteins, opening-up a world of
possibilities for tracking the localization of specific proteins
in living organisms.
The opportunities offered
by GFP were immediately obvious to many, as was the desirability
of extending the range of available tags. Roger Tsien first
studied precisely how GFP's structure produces the observed green
fluorescence, and then used this knowledge to tweak the structure
to produce molecules that emit light at slightly different
wavelengths, which gave tags of different colours. In time, his
group added further fluorescent molecules from other natural
sources to the tag collection, which continues to expand. Complex
biological networks can now by labelled in an array of different
colours, allowing visualization of a multitude of processes
previously hidden from view.
朝日新聞 2008/10/8
ノーベル化学賞に海洋生物学者の下村脩さん
スウェーデンの王立科学アカデミーは8日、今年のノーベル化学賞を米ウッズホール海洋生物学研究所・元上級研究員の下村脩さん(80)=米マサチュー
セッツ州在住=と米国の研究者2氏の計3人に贈ると発表した。下村さんは、オワンクラゲの発光の仕組みを解明する過程で、緑色蛍光たんぱく質(GFP)を
分離し、その構造を解明した。GFPは、細胞内で動く分子を追跡する便利な「道具」として世界中で使われている。
Osamu Shimomura,
Martin Chalfie and Roger Y. Tsienの3氏
米コロンビア大学のチャルフィー教授は、線虫などを使ってGFPが色の「印」に使えることを立証、さまざまな生理学的現象に応用できることを示した。
また、米カリフォルニア大学サンディエゴ校のチャン教授はGFPの発光メカニズムについて詳しく研究し、緑色以外の色にも発光するような手法を開発、タンパク質や細胞に異なった色をつけることに成功した。
3氏には賞金1000万スウェーデン・クローナ(約1億5000万円)が贈られ、3等分する。授賞式は12月10日に、ストックホルムで行われる。
日本人のノーベル賞受賞は16人目。化学賞は02年の田中耕一・島津製作所フェローに続き5人目。授賞式は、12月10日にストックホルムである。賞金1千万スウェーデンクローナ(約1億4千万円)は受賞者で分ける。
たんぱく分子は大きさがわずか10ナノメートル(ナノは10億分の1)程度と小さく、そのままでは光学顕微鏡で観察できない。そこで、特定のたんぱく分子にGFPをくっつけて光らせることで、観察できるようになった。たんぱく質に目印の電球をつけるようなものだ。
下村さんは、発光する生物から発光物質を取り出し、その仕組みを地道に研究してきた。1962年、オワンクラゲから、発光物質としてイクオリンと
いうたんぱく質とGFPを取り出して発表した。さらに、イクオリンがカルシウムと結合することで青く光り、そのエネルギーを使ってGFPが緑の光を出すこ
とを70年代に解明した。
90年代になって、ウッズホール海洋生物学研究所のダグラス・プラッシャー氏がGFPをつくる遺伝子を同定。ほかのたんぱく質とくっつけて細胞に
組み込む方法を米コロンビア大のマーチン・シャルフィエ氏が発見した。細胞が生きたまま、中のたんぱく質を観察する「便利な」手法として世界中の研究室で
使われている。
下村さんは60年、米国の大学に招かれ、氷川丸の最後の航海で、太平洋を横断。発光メカニズムの研究ひとすじにうちこんだ。海洋生物学研究所を退職した後も、自宅で研究を続けている。
◇
〈下村脩さんの略歴〉
1928年 京都府生まれ
51年 長崎医科大付属薬学専門部卒業
55年 名古屋大学理学部有機化学研究生
60年 米プリンストン大学研究員
63年 名古屋大助教授
65年 米プリンストン大上席研究員
81年 米ボストン大客員教授
82年 米ウッズホール海洋生物学研究所上席研究員
01年 自宅に研究室をつくり、研究を続ける
07年 朝日賞 (2006年度)
| 田辺聖子 |
『田辺聖子全集』(全24巻・別巻1)完結にいたる文学活動の業績
|
| 村上春樹 |
世界各国で翻訳され、若い読者を中心に同時代の共感を呼んだ文学的功績
|
| 野村万作 |
長年にわたる狂言の優れた上演と幅広い舞台芸術への貢献
|
| 川人光男 |
小脳内部モデル理論の提案・検証と人型ロボットによる脳機能の解明
|
| 近藤孝男 |
生物時計の分子機構に関する研究 |
下村脩
|
緑色蛍光たんぱく質GFPの発見と生命科学への貢献
|
「当時、発光物質は酵素の働きで光ると信じられていた。だが、絶対に酵素が必要なのか。毎日、ボートで海に出て、考え続けた」
ある日、光り終えた液体を捨てたら、海水と混じって、また光った。酵素でなく、海水中のカルシウムと反応して青く光るたんぱく質エクオリンを見つけた。さらに、この光を受けて緑色に光るGFPも一緒に発見。両者の構造を解き明かし、生命科学へ応用する道を開いた。
44年、大阪市から長崎県諫早市に疎開。地元旧制中学に編入したが、わずか1日で軍需工場に動員された。戦後、旧制高校を目指したが失敗。1日だけの中学に成績表がなく、まともな内申書が手に入らなかったからだという。
自宅で勉強を続け、48年に長崎医科大付属薬学専門部に入学。名古屋大研究生だった56年、ウミホタルの発光物質の結晶化に世界で初めて成功し、渡米につなげた。
「絶対に不可能だと決まっていないことは、必ずできる」。今は自宅でホタルイカの発光の仕組みの解明に挑んでいる。
| ウイキペディア イクオリン(aequorin)は、1962年、下村脩とFrank
H. Johnson(当時プリンストン大学)らによってオワンクラゲ(Aequorea
victoria)から発見・抽出・精製された発光タンパク。当時はカルシウム濃度をタンパクが感受し発光する、という発想があまりに斬新だったため、イクオリンの発見は驚くべき反響をもって迎えられた。イクオリンはクラゲの発光細胞
内で、カルシウムの濃度を感知して、発光するが、その発光原理は、充電したバッテリーにもたとえられる。イクオリンはセレンテラジンという物質を核にもつ
が、高カルシウム濃度ではセレンテラジンがセレンテラマイドに変化し、このとき発光する。
ただし、カルシウム存在下でのイクオリンの発光は単体では青色であるにもかかわらず、オワンクラゲは緑色に発光する。これは、オワンクラゲの細胞内で、イクオリンが、別のタンパクGFPと複合体をなしているためで、イクオリンの蛍光波長が、GFPに吸収され(フェルスター型エネルギー転移)、緑色にシフトするためである。この発見も、イクオリンの発光原理と同様、下村脩によってなされたものであり、同時に、彼によってGFPも初めて分離・精製されている。
|
「緑色蛍光タンパク質(GFP)の発見と生命科学への貢献」により、2006年度朝日賞を受賞。
「緑色蛍光タンパク質(GFP)の発見と開発」の発見によって、2008年にノーベル化学賞を受賞。
コンピュータセキュリティ専門家でケビン・ミトニック Kevin
Mitnick 逮捕に関わった下村務は息子。
ケビンと下村の対決は映画化されている(『ザ・ハッカー』・原題:Takedown)。
2008/1/14 産経ニュース
発光生物学者・下村脩さん 緑色蛍光タンパク質を発見
■定説覆す仕組みを解明 生命科学に画期的貢献
ホタルなどの生物が作り出す光は
神秘的で、多くの謎に包まれている。この生物発光の研究で先駆的な業績を挙げたのは米国在住の下村脩博士だ。1960年代にクラゲから緑色蛍光タンパク質
(GFP:green fluorescent protein)を発見。これを標識に使うことで、生きた細胞内で物質の動きを観察できるようになり、生命科学の研究に革命的な進歩をもたらした。
1961(昭和36)年夏。留学先の米プリンストン大から実験器具を車に積み込み、約5000キロ離れたシアトル北部の臨海実験所へ向かった。沿岸を漂う「オワンクラゲ」が放つ光の謎を突き止めるためだ。
オワンクラゲは、おわん形の傘(直径10〜20センチ)の縁が緑色に光る。ホタルに代表される生物の発光現象は当時、ルシフェリンという発光物質と酵素の
反応で起きると考えられていた。このため無数のクラゲを網で捕獲し、体内のルシフェリンを抽出しようと実験を繰り返したが、見つからない。
「ルシフェリンにこだわらず、何でもいいから光る物質を抽出しよう」。“非常識”な提案を教授は認めなかったが、自分で勝手に新しい実験を始めた。
発光物質を取り出すためには、光らない状態にしておく必要がある。光った後では、その物質は分解されてしまうからだ。さまざまな薬剤を使って試したが、失敗の連続だった。
「なぜ光るのか。どうすれば抑えられるのか。昼も夜も、ただ考え続けた」。ある日の午後、ボートをこいで海に出た。寝そべって波に揺られながら考えていると、突然ひらめいた。
「生物の発光だから、タンパク質が関係しているはず。それならpHが影響するのではないか」
すぐに実験したところ、溶液を酸性(pH4)にすると光らなくなることが判明。ようやく抽出条件を見つけ、気をよくして溶液を流しに捨てた瞬間、「流しの
中がバーッと爆発的に青く光った」。実験所の流しには普段から海水が流れ込んでおり、海水中のカルシウムイオンと反応して強く光ったのだ。
この物質はオワンクラゲの学名(Aequorea
victoria)にちなんで「イクオリンaequorin
」と命名した。その後も毎年夏、家族総出で5万匹以上のクラゲを捕り続け、17年かけてその発光メカニズムを解明した。
しかし、イクオリンは青色なのに、オワンクラゲはなぜ緑色に光るのか
ーーー。実はイクオリンを精製した際、緑色に輝く微量の副産物を見つけ、捨てずに分析を続
けていた。その正体は緑色蛍光タンパク質(GFP)。この物質が青い光のエネルギーを受け取り、緑の光を放出していることを突き止めた。
| イクオリンは発光で、GFPは蛍光を出します。イクオリンは、カルシウムと結合し、自らつくり出したエネルギーで青く光ります。一方、GFPはこの時の発光エネルギーを奪って緑色に光るわけです。イクオリンとGFPで、発光と蛍光の仕組みを全部解いてしまったことが下村先生の偉業です。当時、手がかりはほとんどなかったと思います。 |
「美しいだけが取りえで、何の価値もない物質だった」というGFP。しかし、その発光の仕組みは定説を覆すものだった。蛍光タンパク質のほとんどは、タン
パク質と他の発光化合物との複合体だが、GFPはタンパク質だけで自ら発光する変わり種。このため生体内で作り出せる特徴があり、遺伝子工学が進歩した
90年代に入って一躍、脚光を浴び始める。
調べたいタンパク質の遺伝子に、GFPの遺伝子を融合させると、その蛍光が目印になり、目的のタンパク質が細胞内のどこに存在し、どのように運ばれるのかといった分布や挙動が、一目で分かるようになった。
GFPを使った蛍光マーカーの登場は、分子生物学や基礎医学を飛躍的に進展させた。現在でも生命科学の研究に欠かせない“武器”として、世界中で利用されている。
「こんな物質が存在するとは誰も予想しなかった。発見できたのは奇跡的な幸運。天の恵みです。多くの研究に役立つことができてうれしい」
多数のノーベル賞受賞者を輩出したことで知られる米ウッズホール海洋生物学研究所を6年前に退職した。実験器具は持ち帰り、今も自宅で研究を続ける。
研究テーマはもちろん生物発光。「次は光るキノコ。光る理由が分かっていないし、難しくて誰もやろうとしないから。人がやらないことをやるんですよ、ぼくは」
ウミホタルとの出合いが契機
京都府福知山市生まれ。陸軍将校の長男で幼少期を満州、大阪で過ごす。中学生のとき長崎へ疎開し、転校初日に学徒動員で軍需工場へ駆り出された。終戦後も中学の卒業証書がないため、高校に進学できなかった。
行くあてもなく途方に暮れていたところ、原爆で破壊された長崎医科大付属薬学専門部(現長崎大薬学部)が、たまたま近所に移転してきた。
「機械が好きで、船の設計をしたかった。薬なんて何の興味もなかったが、ほかに選択肢がなかった」。不本意ながら同専門部に入学、首席で卒業した。
「上の人の話を素直に聞くような人間じゃない。人と争う気もないし、競争は嫌い」。大手製薬企業の面接を受けたところ、「君は会社には向かない」と忠告され、大学に残った。
生物発光との出合いは名古屋大の研究員時代、教授の薦めで甲殻類のウミホタルを研究したのがきっかけ。米プリンストン大が20年かけてもできなかった発光成分の結晶化にわずか1年で成功、頭角を現した。
「自分はアマチュア・サイエンティスト。それがかえって良かったのかも」と、穏やかな笑顔で謙虚に振り返る。米国生活はすでに45年。国内より海外の方が知名度が高いのは、型破りの独創性の証しでもある。
【プロフィル】下村脩
しもむら・おさむ 昭和3年8月、京都府生まれ。26年、長崎医科大付属薬学専門部(現長崎大薬学部)卒。助手を経て35年、名古屋大で理学博士号を取
得、米プリンストン大研究員。名古屋大助教授などを経て57年、米ウッズホール海洋生物学研究所上席研究員。平成13年、同研究所退職。19年、朝日賞。
◇
■美術鑑賞 主に印象派のデッサン、水彩画、版画に興味がある。美術館や町のギャラリー、古本屋をのぞく。科学者として正しいゆがみのない思考力を持つためには、科学とまったく違う趣味を持つのがよい
■健康法 毎日1時間歩きたいと思っているが、なかなか実行できない。食べ過ぎないことは大事。身長は182センチ
■信条 「難しいからやらない」という発想が一番嫌い。物事は難しく見えても、できてしまえば簡単なものだ
■若手研究者に一言 研究をやり始めたら、できるまでやめるな。一度ギブアップすると、くせになる
■家族 米マサチューセッツ州で妻と2人暮らし。子供は1男1女
2010/7/22 日本経済新聞 私の履歴書
オワンクラゲから私が発見した発光物質のイクオリン。イクオリンが光るためのカギを握ると狙いをつけていた物質「AF350」の化学構造が判明したのは、1972年のことだった。67年から5年をかけて、家族も総出で、のべ25万匹ものクラゲをとり、そこから抽出した成分をもとに構造を決定できた。
その中で、私は思いがけないことに出合った。このAF350には、私が見慣れていた化学構造とよく似たものが含まれていたのだ。
十数年前、名古屋大学の研究生をしていたころ扱っていたウミホタルの発光物質ルシフェリンの酸化物中にあって、当時見つけていた化学構造と共通したものが、AF350の中にもあったのだ。構造の端の部分は異なっていたが、よく似ていた。
このことは、全く別物同士と思われていたオワンクラゲの発光と、ウミホタルの発光との間に、密接な関係があることを物語っていた。その後の我々の研究で、イクオリンの発色団(発光を担う化学構造)が、セレンテラジンと我々が命名した化合物であることが分かった。
ウミホタルとオワンクラゲにはどのような関係があるのだろうか。それまで知られていた、ウミホタルなどのルシフェリンとルシフェラーゼ(酵素)による発光と、イクオリンの発光が異なるのは、イクオリンの発光には酸素が不要で、カルシウムを加えただけで光るという点であった。
イクオリンは分子量が約2万の球状をしたたんぱく質で、その真ん中にセレンテラジンの過酸化物が入っている。ニワトリの卵を想像してもらうと、イクオリンが卵全体で、セレンテラジンの過酸化物は黄身に相当する。白身がイクオリンのたんぱく質部分だ。
もし、カルシウムイオンが周囲にあると、それがイクオリンに結合して、白身に相当するたんぱく質部分が変形する。その変形によって中のセレンテラジンが分解して光を出す。光った後のたんぱく質部分にセレンテラジンを加えて放置すると、もとのイクオリンに戻る。
つまり、セレンテラジンは、ルシフェリンのような役割をもち、たんぱく質がルシフェラーゼのような働きをしている。イクオリンというたんぱく質の内側で、ルシフェリンとルシフェラーゼによるのと似た、反応が起きているのだ。
このようなイクオリンの発光の仕組みの全体像が分かったのは、75年のことだった。その後、セレンテラジンは、イクオリンだけでなく、多くの発光生物の中で発見されている。
イクオリンというたんぱく質は、カルシウムイオンが結合すると、あたかも充電されていたかのように発光する。「放電」した後も、セレンテラジンによってまた充電することができる。このような、まるでバッテリーのような働きをするたんぱく質を、私はこれまで見たことがなかった。この不思議なたんぱく質を創造した自然の偉大さを感じないわけにはいかなかった。
もしも我々が、あらかじめこのウミホタルのルシフェリンの構造を知らなかったら、イクオリンの発光のメカニズムの研究は進まなかったと思う。私はここでも幸運だった。
「GFP」の研究を終了 発見から18年、正体を解明
後に私のノーベル化学賞受賞の業績となる、緑色蛍光たんぱく質GFPは、もともとは1961年、オワンクラゲから、発光たんぱく質のイクオリンと同時に発見していたものだった。GFPは結晶になりやすい美しい蛍光たんぱく質である。
GFPは当初はイクオリンとは違い、何の使い道もないものだったが、私はこの蛍光たんぱく質のことが気になっていた。オワンクラゲの発光の色は緑色であり、イクオリンの出す青色とは異なる。緑の蛍光を示すGFPはオワンクラゲの発光のカギを握っているに違いなかった。
その謎に一応の答えを出したのは74年のことだった。オワンクラゲが緑色に光るのは、イクオリンの青い光のエネルギーを、GFPが緑の光に転換するためであることを証明した。イクオリンのそばにGFPがあると、イクオリンがカルシウムによって発光しようとするとき、そのエネルギーがGFPに移り、GFPが緑に光るのだ。
だが、GFPが蛍光を出す仕組みそのものの解明はそれからだった。79年、それまでためておいたGFPを使って、その蛍光の原因となる発色団(化学構造)を調べ始めた。使ったのは、採集に数年をかけたオワンクラゲ約20万匹分にあたる、100ミリグラムのGFPである。
まず、たんぱく質を分解する酵素を使って、GFPを小さい断片(ペプチド)に分解した。得られた無数のペプチドの中から、発色団を持つものを選び出して精製した。その発色団の、光を吸収する性質を測定したとき、私は驚いた。というのは、その性質が、私が20年前にウミホタルのルシフェリンの研究中に合成していた、ある化合物とそっくりだったからである。
このことを手掛かりに、私はGFP内にあると推定される化合物を合成した。その特性は実際にGFPから得られた蛍光ペプチドと完全に一致した。とうとう、GFPの発色団の正体を突き止めた。
その意味するところは、それまで考えられもしなかったことだった。
普通の蛍光たんぱく質は、たんぱく質に蛍光化合物が結合している。つまり2つの分子からできている。しかし、GFPはこれとは全く違っていた。たんぱく質の中に蛍光発色団が組み込まれ、これを含めて1つのたんぱく質分子をなしているのである。GFPは200個以上のアミノ酸からできているが、その中の3つのアミノ酸が、分子内で反応を起こし、発色団を作っていることがわかった。
79年のこの発見は、その重要性から見て、GFPの本当の発見といえる。最初にGFPが発見されてから18年目のことだった。
GFPの構造を発表したこの年、私はラトガース大学のワード博士が、オワンクラゲのGFPの研究を始めたことを知った。博士はウリクラゲの発光たんぱく質の研究で見事な手腕を発揮した人物だった。
私の主な目的は、生物発光のメカニズムの解明であり、副産物のGFPについては、私はできるだけのことはしたし、やり残したことはないと判断した。GFPの研究はやめ、他の生物発光の研究に全力をつくすことにした。この不思議な蛍光たんぱく質が再び脚光を浴びるのはしばらく後のことである。
「GFP」脚光
90年代、進展する研究 発見は幸運のたまもの
1979年にオワンクラゲから得た緑色蛍光たんぱく質GFPの発色団(光が出るための化学構造)を決めた後、私はGFPの研究から完全に手を引いた。その後、GFPを応用する研究は90年代に入り、大きく進展した。
GFPが他の蛍光たんぱく質と異なるのは、たんぱく質自身の中に蛍光発色団が組み込まれて1分子である点だ。このたんぱく質を作る遺伝子を使えば、GFPを人工的に作れる可能性がある。
92年にウッズホール海洋学研究所にいたダグラス・プラッシャー博士が、GFPのクローンを作り出した。ただ、この時点では、クローンのGFPは別の酵素の助けなしで蛍光発色団を作るのは難しいと考えられていた。
この見方を覆したのが、米コロンビア大学のマーティン・チャルフィー教授である。教授は94年、GFPを生きた生物中で働かせることを実証した。線虫の体内で、GFPが緑色に光る写真が、米サイエンス誌の表紙を飾った。さらに米カリフォルニア大学のロジャー・チェン博士はGFPに改良を加え、本来の緑色だけでなく、様々な色の蛍光を出すたんぱく質を作った。
現在、GFPとそれを改良した蛍光たんぱく質は、生体内のたんぱく質や組織に印をつけるマーカーたんぱく質として、世界中で広く使われ、医学や生物学の研究に欠くことのできない道具になった。この応用面の立役者であるチャルフィー、チェンの両博士は、ノーベル化学賞の共同受賞者である。
GFPは計画して発見されたのではない。オワンクラゲの発光の研究中に副産物として発見されたのであり、この発光クラゲの研究なくしてはその発見はなかったはずだ。
仮にGFPを私が発見していなかったとすると、代わりに誰かがGFPを発見していただろうか。誰かその存在を予測していただろうか。そんなことは考えられない。しかし、仮にそんな予測があったとしても、それを確かめるためには、そのたんぱく質を検出する方法を考案し、いろいろなたんぱく質を抽出して、その中に実際にGFPのようなものがあることを証明する必要がある。それは膨大な仕事で、誰もやらないだろう。ということは私が発見していなかったら、誰もGFPを発見していないであろう。
私の発見は幸運なことが重なって起きた。まず私が研究したオワンクラゲの中にイクオリンとGFPという2つが存在していたこと。もしGFPだけだったら、だれもそれを研究しなかったはずだ。もう一つ幸運だったことは、私が以前に行っていたウミホタルの研究の結果が、GFPの解明に絶対必要だったことだ。
さらに一つ。不思議なことだが、以前はあれほどたくさんいたオワンクラゲが、我々の研究が済んだ後、90年ころに突然消えうせたのだ。以来、2〜3匹のクラゲを採ることさえ容易でなくなった。
その原因は天然現象かもしれないし、89年に起きたオイルタンカー、エクソン・バルディーズ号の原油流出事故による海洋汚染かもしれない。このようなことが20年早く起きていたら、GFPは発見されず、現在この世にGFPは存在しないだろう。
日本経済新聞 2008/10/12
ノーベル化学賞 下村脩氏
細胞観察に光る目印 先端医療に大きな恩恵
化学賞の受賞が決まった下村脩・米ボストン大学医学校名誉教授は、発光するクラゲから緑色に光る蛍光のたんぱく質(GFP)を発見した。GFPは体をつくる細胞の様子をくわしく調べるときに欠かせない研究用の道具になり、病気の原因を調べたり医薬品を開発したりする医学研究の発展につながった。
蛍光たんぱく質 クラゲ由来の緑色
クラゲやサンゴ、キノコなど生物が光を出すために使うたんぱく質。受賞対象となった緑色蛍光たんぱく質(GFP)はクラゲから見つかり、緑色に光る。クラゲの体内では「イクオリン」と呼ばれる別のたんぱく質から光を受け、緑色を出す。遺伝子を動物などに導入するとGFPが体内でできるため、これを手掛かりに体の中でどんな物質が作られているかなどがわかる。GFPを初めて生物内に導入して光らせたのが共同受賞者のMartin
Chalfie 米コロンビア大学教授で、Roger
Tsien
米カリフォルニア大学サンディエゴ校教授はGFPをもとに赤色や黄色などの色に光るたんぱく質をつくった。 |
GFPはGreen
Fluorescent Protein
の略。下村氏は渡米後、ワシントン州のシアトル郊外の海に来る日も来る日も通い、のべ85万匹のクラゲを採取。緑色に光るオワンクラゲからこのたんぱく質を61年に見つけた。
クラゲの体内では、まず「イクオリン」と呼ばれる別のたんぱく質が細胞内のカルシウムイオンと反応して青白く光る。この光をGFPが受け取って、魅惑的なクラゲの光を生み出していた。
「当時、応用なんて全く考えていなかった」と下村氏は振り返る。共同受賞者となったマーティン・チャルフィー米コロンビア大学教授らが94年に、ほかの生物の体の中でGFPを光らせることに成功し、医学研究に使えることが初めて明らかになった。
医学の実験は細胞の様子を詳しく調べるのが研究の第一歩だ。GFPの遺伝子をほかのたんぱく質の遺伝子にくっつけてマウスなどに入れれば、緑色を手掛かりに、体のどの細胞でほかのたんぱく質がうまく働いたかどうかがひと目でわかる。
がん細胞なら転移や増殖するかどうか、アルツハイマー病なら神経細胞がどうやって壊れていくのか、糖尿病なら膵臓の細胞がどのように血糖値を下げる成分(インスリン)を出しているかなどが分かる。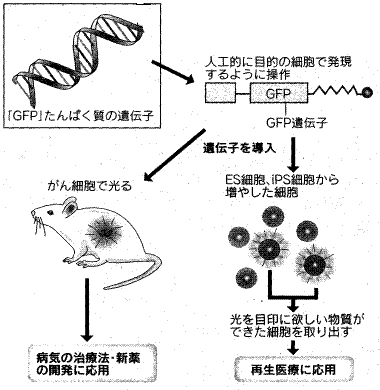
これはがんなどの治療薬開発には欠かせない情報だ。GFPが登場するまではほかの染色物質を使っていたが「細胞を生きたまま調べられない難点があった」(実験動物中央研究所)ため、薬の効果の正しい評価がしにくかった。下村氏の成果は病気に苦しむ世界の患者に大きな恩恵をもたらしたといえる。
最先端の研究でも活躍する。脊髄損傷など難病に光明をもたらす人間の新型万能細胞(iPS細胞)を世界で初めて作製した京都大学の山中伸哉教授もGFPの恩恵を受けた一人。GFPの目印を付けた4個の遺伝子を皮膚の細胞に入れ、GFPを手掛かりにいろいろな細胞に育つ「万能性」を持つかどうかを見極めた。
慶応大学の岡野栄之教授も万能細胞の一つの胚性幹細胞(ES細胞)から運動にかかわる神経伝達物質ドーパミンを作る細胞だけをGFPで光らせ、効率よく選ぶ手法を開発した。GFPは将来の病気治療のための原動力にもなる。
下村氏は01年に米ウッズホール海洋生物研究所を退職後も自宅に研究室を移し、妻と研究を続ける。論文も単独で執筆することが多い。同研究所時代の下村氏のもとに留学した三重大学の寺西克倫教授は「自分にも他人にも厳しく情熱的な研究者。一人で考え、自ら手を動かす人だ」という。この飽くなき好奇心が大きな成果をもたらした。