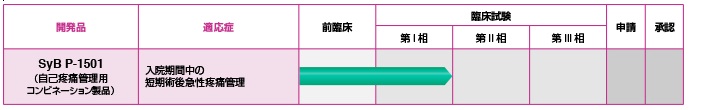
シンバイオは、2015年10月2日にThe Medicines Company社(米国)からSyB P-1501の日本における独占的開発権・販売権を取得しました。
シンバイオ製薬
| 2005年 3月 | シンバイオ製薬設立 |
| 2005年12月 | アステラス ファーマ社(ドイツ)より抗がん剤「Bendamustine Hydrochloride」の日本における独占的開発および販売に関するライセンス契約を締結 |
| 2007年 3月 | アステラス ドイッチラント社(ドイツ)より抗がん剤「SyB L-0501」の中国、韓国、台湾およびシンガポールにおける独占的開発および販売に関するライセンス契約を締結 |
| 2008年 8月 | 抗がん剤「SyB L-0501」に関するライセンス契約をエーザイと締結 |
| 2009年 3月 | 中国における抗がん剤「SyB L-0501」の開発、および商業化権を供与するサブライセンス契約をセファロン社(米国)と締結 |
| 2009年 5月 | 韓国とシンガポールを対象とした抗がん剤「SyB L-0501」に関するライセンス契約をエーザイ株式会社と締結 |
| 2010年 9月 | 低悪性度非ホジキンリンパ腫、および慢性リンパ性白血病を適応症として「Symbenda®」(一般名:ベンダムスチン塩酸塩)をシンガポールで新発売 |
| 2010年 10月 | 抗悪性腫瘍剤「トレアキシン®」の国内製造販売承認取得 |
| 2010年 12月 | 抗悪性腫瘍剤「トレアキシン®」の国内販売開始 |
| 2011年 7月 | オンコノバ社(米国)と抗がん剤「SyB L-1101/SyB C-1101」に関するライセンス契約を締結 |
| 2011年 10月 | 慢性リンパ性白血病および多発性骨髄腫を適応症として「Symbenda®」(一般名:ベンダムスチン塩酸塩)を韓国で新発売 |
| 2012年 2月 | 低悪性度非ホジキンリンパ腫および慢性リンパ性白血病を適応症として「Innomustine®」(一般名:ベンダムスチン塩酸塩)を台湾で新発売 |
| 2015年 10月 | The Medicines Company社(米国)と自己疼痛管理用コンビネーション製品「SyB P-1501」の日本における独占的開発および販売に関するライセンス契約を締結 |
| 2016年 5月 | SymBio Pharma USA, INC.
(シンバイオ ファーマ ユーエスエー インク)を米国カリフォルニア州メンローパークに設立
|

アステラス ドイッチラント社(ドイツ)より抗がん剤「SyB L-0501」の中国、韓国、台湾およびシンガポールにおける独占的開発および販売に関するライセンス契約を締結
2005年12月 Astellas Deutschland GmbHより抗がん剤「Bendamustine Hydrochloride」の日本における独占的開発および販売に関するライセンス契約を締結 日本、中国、韓国、台湾、およびシンガポールにおける独占的開発および販売に関する権利を取得
米国においてはCephalon, Inc.(ペンシルベニア州)が慢性リンパ性白血病及び低悪性度非ホジキンリンパ腫の新規化学療法剤として、米国食品医薬局(FDA)から2008年に承認取得し、米国臨床腫瘍学会(ASCO)の2008年度に最も重要と考えられる研究を総括した報告書の中で、慢性リンパ性白血病の治療に大きな影響を与えた新薬として選ばれています。
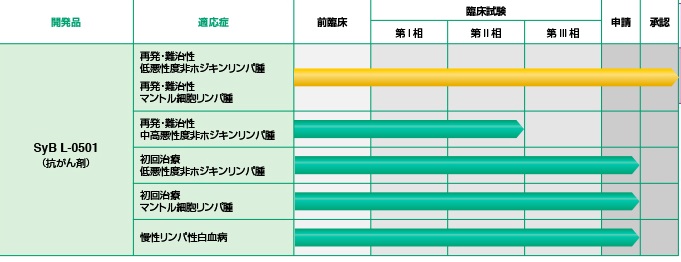
シンバイオ製薬ではアステラス製薬株式会社のドイツ子会社であるAstellas Deutschland GmbH(ドイツ)より、日本、中国、韓国、台湾、およびシンガポールにおける独占的開発および販売に関する権利を取得しており、2008年8月には、エーザイ株式会社と日本における共同開発・独占販売についてのライセンス契約を締結、2010年10月には再発・難治性の低悪性度非ホジキンリンパ腫及びマントル細胞リンパ腫を適応症として国内での製造販売承認を取得し、同年
12月から、エーザイ株式会社を通じて国内販売を行っています。
中国における抗がん剤「SyB L-0501」の開発、および商業化権を供与するサブライセンス契約をセファロン社(米国)と締結
Onconova Therapeutics (本社:米国ペンシルベニア州、以下「オンコノバ社」)により米国及び欧州において、骨髄異形成症候群(MDS)、及び固形がんを適応症として開発が進められています。
シンバイオ製薬は、オンコノバ社との間で、本剤の日本及び韓国における独占的開発権及び販売権を取得するライセンス契約を2011年7月に締結し、現在、再発・難治性の高リスクMDSを適応症とした注射剤の開発と高リスクMDS(アザシチジンの併用による)及び輸血依存性の低リスクMDSを適応症とした経口剤の開発を進めています。

空白の治療領域で収益化‐抗癌剤を4品目に拡充
シンバイオ製薬は、導出先のエーザイが国内販売中の「トレアキシン」と第II相試験段階にある「リゴサチブ」に加え、他社から海外開発薬剤を導入し、今年度中に癌領域で四つの開発品目に拡充する。吉田文紀社長は、「癌領域で世界に伍するスペシャリティファーマになる」と強調。今後、自社販売体制を構築し、未充足の医療ニーズに根ざしたビジネスモデルとして、収益性の面で製薬大手が開発に躊躇する“売上規模50〜100億円薬剤”の品揃えにより、収益化を目指す考えだ。
2015年で創業10年目を迎える同社は、製薬企業が開発を手掛けない「血液」「癌」「自己免疫疾患」を“空白の治療領域”として、他社が海外開発中の化合物を導入し、上市を目指すビジネスモデルを推進している。中でも、有望な化合物を探し出す「目利き力」と、導入品目の早期上市を実現する「臨床開発力」が強みだ。
導入に向けては、ヒトに対する薬効・安全性指標「プルーフ・オブ・コンセプト」(POC)をクリアした化合物を世界中から探索。過去10年間でPOCを取得した新規化合物約1200件を調査し、最終候補となる導入対象品目は全体の1%未満の10品目以下と、厳しく評価した上で導入判断を行っている。
導入後は、シンバイオの臨床開発部隊が開発戦略を立案し、確実に上市まで導く。専門性の高い人材を抱え、CROにモニタリング業務を外部委託する一方、データマネジメント・統計解析、治験の進捗管理などはシンバイオが担う。
導入して5年の短期間で上市を達成したトレアキシンは、再発・難治性低悪性度非ホジキンリンパ腫・マントル細胞リンパ腫の適応で使われ、薬価ベースで売上約50億円規模と順調に進捗している。2017年までに非ホジキンリンパ腫での適応拡大、慢性リンパ性白血病の適応追加を実現し、薬価ベースで売上200億円規模に最大化する。
第II相試験実施中のリゴサチブは、骨髄異形成症候群(MDS)を目標適応症に、経口剤と注射剤で承認取得を目指す。高リスクMDSを対象としたリゴサチブ注射剤の海外第III相試験「ONTIME」では、主要評価項目で対照薬の緩和維持療法群に対する有意差を示すことができなかったが、低メチル化薬不応例を対象としたサブ解析では生存期間を延長する結果が報告されている。米オンコノバ・セラピューティクスが今年下半期に国際共同第III相試験を実施し、日本も参加する計画。
MDSに対する薬物治療では、日本新薬が販売する「ビダーザ」に限られているが、臨床試験ではリゴサチブ経口剤とビダーザの併用療法で完全寛解が認められた症例もあり、相乗効果も期待できるという。吉田氏は、「19年までにリゴサチブの承認を取得し、自社で販売したい」との方向性を語る。
昨年度売上は19億円、営業損失は13億円で着地した。患者数が少ない反面、医療上必要性の高い50〜100億円規模の薬剤でビジネスモデルを構築するため、収益化するのは「4品目販売できるようになってから」(吉田氏)という。今後の開発パイプライン戦略として、低分子抗癌剤を数カ月以内に導入する予定。さらに今期中に導入を目指すもう1品目については、抗体医薬品を軸に検討している。グローバルでの販売権も視野に交渉を行っており、20年以降の本格成長に向けた事業基盤の構築を急いでいる。