2011/12/21�@���O���@
�����o�N�V�[�̕č��H�i���i�ǂƂ̓��Ӌ��菑�����ɂ���
�@���O���́A���̂��сA�A���q��Ђ̃����o�N�V�[�E���{���g���[�Y�Ёi�{�ЁF�C���h���a���n�����i�B�O���K�I���n��j���A�č��H�i���i�ǁiFDA�j�Ɠ��Ӌ��菑�̒����Ɏ���܂����̂ŁA���m�点���܂��B����ɂ�胉���o�N�V�[�́A�f�[�^�̐M�������m���ɂ��邽�߂̎�i����j���X�ɋ������A���s���K����������������邱�Ƃ��m�邱�ƂƂȂ�܂����B�Ȃ��A�{���Ӌ��菑�́A�����[�����h�n�捇�O���A�M�n���ٔ����̏��F�������Ƃ��Ă��܂��B
�č��H�i���i�ǁi�e�c�`�j��2008�N9��16���A�����o�N�V�[�E���{���g���[�Y�̈��i30��ȏ�̗A�����ꎞ��~�����B
���i�̈��S���ɖ��͂Ȃ����A�����o�N�V�[�̃C���h�̃f���X�ƃp�I���^�E�T�q�u�ɂ���Q�̍H��ŁA�������̐��A���Y�Ǘ��A�i���Ǘ��ȂǂɊւ���L�^�̕ۑ��Ɋւ��Ė�肪���P����Ă��Ȃ����߂Ƃ��Ă���B
�܂��A�e�c�`��1������3���ɂ����Ė��̂Q�H������@�����ہA�R�������̎�舵�����@�ɂ���肪�������ꂽ�Ƃ����B
2009/1/8�@���O���A�����o�N�V�[�̕]�����v��
�@�܂��A�����o�N�V�[�͕č��i�@�ȁiDOJ�j�Ƃ̈Č��̉����Ɍ����\���Ǝv��������Ƃ��āA500�S���ăh�����v������\��ł��邱�Ƃ��Ă��m�点���܂��B�{���̓��ЃO���[�v�̘A���Ɛтɗ^����e�����ɂ��܂��ẮA�ʓr���m�点���܂��B
�������@5���h��
��@-375���~
�������厝���T����@-240���~
�@���Ђ́A�����o�N�V�[�̑S�Ă̎{�݂��A�@�K�������炵�����������Ŏ��Ɛ��s���邱�ƂɈ�������g�݁A���җl�����҂̊F�l�ɉ��l���鐻�i�����悤�A�ϋɓI�Ɋ֗^���ĎQ��܂��B
�@�����o�N�V�[�́A���E�ő�̈��i�s��ł���č��ɂ����āA�A�g���o�X�^�`�����܂ފ����i�̊g��ɉ����A�d�v�V���i�̏�s�Ɍ����Ď��Ɗ������������Ă����܂��B
�@���O���O���[�v�́A�����o�N�V�[�̎��Ƃ�����ɔ��W�����A�n�C�u���b�h�r�W�l�X���f���̓W�J�ɂ��O���[�o�����Ƃ��������Ă����܂��B
�[�[�[
2013�N5��14���@���O���@
�����o�N�V�[�̕č��i�@�ȂƂ̋��c�̏I���ɂ���
���O���́A���̂��сA�A���q��Ђ̃����o�N�V�[�E���{���g���[�Y�i�{�ЁF�C���h���a���n�����i�B�O���K�I���n��j���A2011�N12�����\�̕č��i�@�ȂƂ̋��c���I���������Ƃ\�������܂����̂ŁA���m�点�������܂��B
�]�O��肨�m�点���Ă���Ƃ���A�����o�N�V�[�́A�ߋ��̈ꕔ�{�݂ɂ�����f�[�^�̐M��������H���Ɋւ��ADOJ�ɂ�钲�����A����ɑS�ʓI�ɋ��͂��Ă܂���܂����B���ʁA�����o�N�V�[����т��̊֘A��Ђ́A���U�����֎~�@�iFalse
Claims
Act�j�̈ᔽ�Ɋւ��A�č����{���̑��W����B�Ƃ̊ԂŖ�����̘a���Ɋւ��鍇�ӂ��s���A�܂��A����ɉ����A�����o�N�V�[�̕č��q��Ђł��郉���o�N�V�[USA,
Inc.�́A�A�M�H�i���i���ϕi�@�iFood, Drug and Cosmetic
Act�j���̈ᔽ�ɂ��ėL�߂�F�߂܂����B����ɂ��A�����o�N�V�[��DOJ�̋��c�͏I���Ɏ����Ă���܂��B�{���Ɋւ��郉���o�N�V�[�̎x���z�́A���v�Ŗ�500�S���ăh���ƂȂ�܂��B
�Ȃ��A2011�N12���ɂ��m�点�����Ƃ���A�����o�N�V�[�́A�č��H�i���i�ǁi�ȉ��uFDA�v�j�Ɠ��Ӌ��菑��������A�f�[�^�̐M�������m���ɂ��邽�߂̎�i����j���������A���s�̓K������������炷�邱�Ƃ��m�Ă���܂��B�܂��A����DOJ�ƍ��ӂ��ꂽ�x���z�ɂ��ẮA����2011�N�x���Z�ɂ�����500�S���ăh���̈����Ă��v�サ�Ă���܂��B
���̂��сA�����ɂ킽�����{���̋��c���I���������Ƃ����m�点�ł��邱�Ƃ́A���ЂɂƂ��đ�ϊ�������Ƃł���܂��B���Ђ́A����Ƃ��A�����o�N�V�[�̑S�Ă̎{�݂��@�K�������炵�����������Ŏ��Ɛ��s���邱�ƂɎ�g�݁A���ҁE����҂̊F�l�ɉ��l���鐻�i�����悤�A�ϋɓI�Ɋ֗^���Ă܂���܂��B
2012�N3��2���@���O��/�O���N�\�E�X�~�X�N���C��
���N�`�����Ƃɂ�����헪�I��g�ɂ���
�O���N�\�E�X�~�X�N���C���E�o�C�I���W�J���Y�iGSK Biologicals �x���M�[�j�A�O���N�\�E�X�~�X�N���C���iGSK
Japan�j�Ƒ��O��������Ёi�{�ЁF�����s������A�В��F���R樎��A�ȉ��u���O���v�j�́A���N�`�����Ƃɂ�����헪�I��g�Ƃ��āA�ܔ��o���ɂ�鍇�ى�Ёu�W���p�����N�`��������Ёv�i�ȉ��A�u�V��Ёv�j�̐ݗ��ɍ��ӂ��A���̂قnj_���������܂����̂ŁA���L�̒ʂ肨�m�点���܂��B
�P�D�V��Аݗ��̔w�i�E�Ӌ`
�@�ߔN�A�Ȋw�̐i���ɂ��\�h��Â̐i�W�ɂ��A���N�`���ɑ���S�����ɍ��܂��Ă���Ȃ��A���{�ɂ����ẮA��i���Ŋ����Ǘ\�h�Ɍ��ʂ��グ�Ă��郏�N�`���̑������������E�����y�ł����B���N�`���Y�ƃr�W�����i�����J���ȁF2007�N3���j�ɂ����āA���N�`���E���O���������ׂ��Y�Ƌ����̂��߂̕�������A�V�K���N�`���̏��F�E�����ȂǁA���N�`������芪�����ɑ傫�ȕω��ƑO�i�������n�߂Ă���܂��B
�@���̂悤�ȏ��A���{�̈�Ãj�[�Y�ɍ��v�������N�`���̐v���ȋ�������������ׂ��A�O���[�o���ł̊J���m�E�n�E�A�L�x�ȃp�C�v���C���A�Ő�[�Z�p��L���A�ߔN���{�̃��N�`���s��֍v�����Ă���GSK�ƁA���{�ł̊J���m�E�n�E�A���N�`��������ՁA�̔��E���ʖʂɂ�����m�ł���v���[���X��L������O�����A���N�`���̌���Տ��J���A�}�[�P�e�B���O�A�c�Ƌ@�\��S���V��Ђ�ݗ����邱�Ƃƒv���܂����B
�@�V��Ђ́A���Ђ̋��݂����A���N�`�����Ƃɓ���������含�̍�����ƂƂ��āA���{�̓��c�����獂��҂܂ŕ��L���l�X�������ǂ����邱�Ƃ�ڎw���Ă܂���܂��B
��̓I�ɂ́A
�|���{�ɂ����郏�N�`���A�N�Z�X����E���y�ɍv������B
�|�C�O��i���Ŋ����ڎ킳��Ă��郏�N�`�������A���C���i�b�v���g�[����B
�|���Ђ̃��N�`���Z�p�E���i�̑g�ݍ��킹�ɂ��n�����ꂽ�A���D�ꂽ�����̍����������N�`�������B
�|�G�r�f���X�Ɋ�Â��M�����̍������ƈ��苟���ɂ��A���N�`���̕��L�����y����������B
�Q�D�V��Ђ̊T�v
�V��Ђ́A���Ђ��ۗL����\�h���N�`�����i�Ɋւ���J�����Ȃ�тɔ̔������p�����A���{�����ɂ�����Տ��J���A�}�[�P�e�B���O�A�Ȃ�тɉc�Ɗ������s���܂��B���ƊJ�n�����́A���ɔ̔����Ă���GSK�Ȃ�тɑ��O�����Ђ��ۗL���郏�N�`������сA���݊J�����ŋ߂������ɏ��F�擾�\��̐��i����舵���\��ł��B
|
���� |
�W���p�����N�`��������� Japan Vaccine�@ |
|
�ݗ��� |
2012�N4��2�� |
|
���ƊJ�n�� |
2012�N7��2�� |
|
�{�X���ݒn |
�����s |
|
��\�� |
��\������������CEO�@�ΐ؎R�@�r��
��\�������������CEO�@����@�� |
|
���{�� |
1���~ |
|
�o���䗦 |
�O���N�\�E�X�~�X�N���C�����@50���A���O�����@50�� |
|
��Ȏ��Ɠ��e |
���{�����ɂ�����\�h���N�`���̊J���A�̔� |
|
��Ȏ戵�i�� |
�T�[�o���b�N�XCervarix�@�i�q�{��jHuman
Papillomavirus (HPV) vaccine (GSK)
���^���b�N�XRotarix�i���^�ݒ����jRotavirus
vaccine (GSK)
�C���t���G���U���N�`�� Seasonal
flu vaccine
�����ӂ��������N�`�� Mumps
vaccine
DTP���N�`���i�W�t�e���A�E�S���P�E�j�����^�O�퍬���jDiphtheria
Pertussis (DTP) vaccine
diphtheria and tetanus
toxoids and pertussis vaccine
MR���N�`���i���]�E���]�j Measles
Rubella (MR) vaccine �� |
|
�Ј��� |
��200���@�i����MR��120���j |
�R�D�O���N�\�E�X�~�X�N���C���E�o�C�I���W�J���Y�i�x���M�[�j�̊T�v
�O���N�\�E�X�~�X�N���C���E�o�C�I���W�J���Y�̓O���N�\�E�X�~�X�N���C���O���[�v�̃��N�`�����Ƃ𐄐i���鐢�E�L���̃��N�`����Ђł���Ɠ����ɃC�m�x�[�V�����ɂ����郊�[�f�B���O��Ƃł��B���N�`���̌����J���Ȃ�тɐ����ɐϋɓI�Ɏ��g�݁A�\�h���N�`���Ǝ��Ã��N�`���̕����30�ȏ�̃��N�`�����J���������тƁA20�i�ڈȏォ��Ȃ�J���p�C�v���C����L���Ă��܂��B���Ђ̖{���̓x���M�[�ɂ���A���E��14�̐��Y���_��L���Ă��܂��B2010�N�ɂ͐�i������r�㍑�Ɏ���179�J���ɂ�����14���ڎ�ȏ�̃��N�`�����������܂����BGSK�o�C�I���W�J���Y�͂��̐�含�ƌo�������A���E�̑S�Ă̐���̐l�X�̌��N�̂��߂ɍ�����v�V�I�ȃ��N�`�����J�����܂��B
�S�D�O���N�\�E�X�~�X�N���C���̊T�v
|
���� |
�O���N�\�E�X�~�X�N���C��������� |
|
��\�� |
��\��������@�t�B���b�v�E�t�H�V�F |
|
�ݗ� |
1953�N8��18�� |
|
���ݒn |
�����s�a�J���ʃ��J4����6��15�� |
|
���{�� |
20��6,741���~ |
|
���Ɠ��e |
��×p���i�A��ʗp���i�A�g�C���^���[���i�̌����J���A�A���A�����A�̔� |
|
�]�ƈ��� |
��3,500�l |
�T�D���O���̊T�v�@�@�@
|
���� |
���O��������� |
|
��\�� |
��\������В��@���R�@樎� |
|
�ݗ� |
2005�N9��28�� |
|
���ݒn |
�����s��������{���{���O����5��1�� |
|
���{�� |
500���~ |
|
���Ɠ��e |
��×p���i�̌����J���A�����A�̔��Ȃ� |
|
�]�ƈ��� |
��31,570�l�i�A���j�i2011�N9�����݁j |
GlaxoSmithKline (GSK) today announced
that it has signed an agreement with Daiichi Sankyo Co., Ltd. to form a
Joint Venture (JV) which is expected to create the number one vaccines
company in Japan.
The JV will hold the development and
commercial rights for already existing preventative vaccines from both
parent companies. It will supply globally recommended vaccines to help
protect people of all ages in Japan including Human
Papillomavirus (HPV) vaccine, Rotavirus vaccine, Seasonal flu vaccine, Mumps
vaccine, Diphtheria Pertussis (DTP) vaccine, and Measles Rubella (MR)
vaccine. The business will be expanded in the future as new vaccines
in the JV development pipeline are approved.
Both companies will sell their respective
vaccines into the JV at agreed upon prices and expect sales synergies from
the JV. The companies will have an equal stake in the joint venture and
will split the JV�fs profits 50/50 with a portion going toward funding
ongoing capital needs of the JV. There will be a minimal total cash
investment of 100 million Yen (approximately £800,000) split equally between
the two companies to cover the start up capital requirements of the JV.
Christophe Weber, President Designate of
GlaxoSmithKline Vaccines, commented, �gThis collaboration marks another step
in our strategy to build our presence in key growth markets and will create
the first and largest company dedicated solely to vaccines in Japan. We
are very pleased to be partnering with Daiichi Sankyo, a
highly regarded company and an established leader in Japan. Both companies
have strong track records in commercialisation and, in combination, will
create further significant economies of scale in the development and
distribution of vaccines in the Japanese market.�h
Completion of the transaction is expected
in the 3rd quarter of 2012, subject to local regulatory
approvals.
�[�[�[
���ʂ͎q�{��i�����j����Ȃǂ�\�h���郏�N�`���v12��ނ�̔�����B�V��J���͑я��v�]�i�ق�����j�Ɣx�����ۂ̃��N�`������n�߁A�f�r�j���C�O�ŊJ���̔�����50��ވȏ�̒�����J���i���������Ă����B
�q�{��ȊO�ɂ̓C���t���G���U�╗�]�A���c���̍��M�≺���̌����ƂȂ郍�^�E�C���X�ݒ����Ȃǂ̃��N�`����̔�����B�����A�s���ŋL�҉�������O���̒��R�����В��́u�V��Ђ͂f�r�j���J�����̖L�x�ȃ��N�`��������{�ł̊J���i��I�сA���O���̋����c�Ɗ�ՂŔ̔����邱�Ƃ��ł���v�Əq�ׂ��B
�f�r�j�͐��E��30��ވȏ�̃��N�`����̔����A20�i�ڈȏ���J�����Ă���B
�[�[�[
���O���̒��R�����В��͉�Łu���{�ɓ���Ȃ���Ȃ�Ȃ����N�`���͂�������v�Ƃ��āA���{�ł̃��N�`�����ƂŃi���o�[������ڎw���l�����������B�V��Ђ��C�O�W�J����\���ɂ��Ắu�����̌v��͂Ȃ����A���͂��낢��Ƃ���v�Əq�ׂ�ɂƂǂ߂��B���㍂�ȂNj�̓I�Ȍv��́A���ݍ��蒆�Ƃ��āA���炩�ɂ��Ȃ������B
���O���̂Q�O�P�O�N�x�̃��N�`�����㍂�͂P�V�W���~�A�P�Q�i�ڂ�̔����Ă���B�k���������i�����s�`��j�Ƒ��O���Ƃ̍��فA�k�����O�����N�`���́A���Y�ɗ͂�����W��ЂƂ��đ�������B
2011/8/26
�V�^�C���t���G���U���N�`���J���E���Y�̐������Վ������t��
�܂��A�T�m�t�B�ƒ�g���āu�q�u���N�`���v�������Ă��邪�A���̒�g�́u������p������v�i���R�В��j�B
�q�u�����ǁi���ɂ��̋ۂɂ��ې��������ƍA���W���j
���O���́A�q�u�iHib�F�C���t���G���U��b�^�j�ɂ�銴���ǂ�\�h���鏬���p���N�`���ł���A�N�g�q�u®��2008/12/19�����������B�i�������F���E�T�m�t�B�p�X�c�[���ЁA�̔����F���O��������Ёj
�q�u�́A�P�A������݂Ȃǂɂ��A�@�A�̂ǂ�ʂ��đ̓��ɓ��荞�݁A�������i�]��Ґ�����ł��閌�i�����j�̊����ǁj�A�s����,
�A���W���i�����Ƃ���������j�⑼�̏d�ĂȊ����ǂ������N�������Ƃ�����B�A�N�g�q�u®�͂����̃q�u�����ǂ�\�h���邽�߂̏����p���N�`���ŁA���E
100�J���ȏ�ōL���g�p����Ă���B
�O���N�\�E�X�~�X�N���C���́A�\�h���N�`���Ǝ��Ã��N�`���̕���łR�O�i�ڈȏ�̃��N�`����̔����鐢�E�V�F�A�P�ʂ̊�ƁB�Q�O�P�P�N�̐��E���㍂�R���Q�W�U�S���~�̂����A���N�`�����㍂�͂S�P�X�U���~�B���{�ɂ����郏�N�`���r�W�l�X�́A���E�̃��N�`�����㍂�̂P�O�����x�ƂȂ��Ă���B
���O���́A1961�N�ɖk���������ƒ�g���A���N�`���̔����J�n�����B2009�N�ɎГ��Ƀ��N�`�����Ɗ�敔��ݗ����A���N�`�����Ƃ�{�i�W�J�B��N�ɂ͖k���������ƍ��ى�Ёu�k�����O�����N�`���v��ݗ������B
���݂́A�C���t���G���U���N�`����W�t�e���A�A�S���P�A�j�����̎O�퍬�����N�`���Ȃǂ�̔����Ă���B
����AGSK��09�N12���ɔ��������q�{��\�h���N�`���u�T�[�o���b�N�X�v�ŁA�����ł̃��N�`�����Ƃ��J�n�B��N11������́A���c���̃��^�E�C���X�ݒ����\�h���N�`���u���^���b�N�X�v���������Ă���B
�@
�����Ŕ̔�����Ă��郏�N�`�����Ǝ�舵����Ёi����23�N11�����݁j
| ���N�`���̖��� |
��ʓI����
�y���i�ڂ��N���b�N����ƌŒ�\���ł��܂��z |
��舵���̉�Ж� |
| DPT�O�퍬�����N�`�� |
|
�k���A���c�A�������A�������A�c�ӎO�H�A���O���A�A�X�e���X�A�k����i |
| DT��퍬���g�L�\�C�h |
|
�k���A���c�A�������A�������A�c�ӎO�H�A���O���A�A�X�e���X�A�k����i |
| �W�t�e���A�g�L�\�C�h |
|
�������A�c�ӎO�H |
| �j�����g�L�\�C�h |
|
�k���A���c�A�������A�������A�f���J�A�k����i�A���O���A�A�X�e���X�A�c�ӎO�H |
| �|���I���N�`�� |
|
�|���I�� |
| ������i�͂����j���������N�`�� |
|
�k���A���c�A�������A�c�ӎO�H�A���O���A�k����i |
| ������i�͂����j���N�`�� |
|
�k���A���c�A�������A�c�ӎO�H�A���O���A�k����i |
| �����N�`�� |
|
�k���A���c�A�������A�c�ӎO�H�A���O���A�k����i |
| ���{�]�����N�`�� |
|
�������A�������A�c�ӎO�H�A���c�A�A�X�e���X |
| BCG���N�`�� |
|
���{BCG |
| �G�ߐ��C���t���G���U���N�`�� |
|
�k���A�������A�������A�f���J�A�c�ӎO�H�A���O���A�A�X�e���X�A�k����i�A���c |
| �����ӂ��������N�`�� |
|
�k���A���c�A���O���A�k����i |
| �����i�݂��ڂ������j���N�`�� |
|
�������A�c�ӎO�H |
| B�^�̉����N�`�� |
|
�������AMSD�A�A�X�e���X |
| A�^�̉����N�`�� |
|
�������A�A�X�e���X |
�y�x�����ۃ��N�`���z
�Q�R���x�����ۑ����̃��N�`�� |
|
MSD |
�y�x�����ۃ��N�`���z
�����p�x�����ۃ��N�`���i�V���x�����ی����^���N�`���j |
|
�t�@�C�U�[ |
| ���M���N�`�� |
|
SP |
| �q�u�iHib�j���N�`�� |
|
SP |
| �q�{�N�`���i HPV���N�`���j |
|
GSK |
|
|
MSD |
| ���^�E�C���X���N�`�� |
|
GSK |
| �R�őf |
|
������ |
|
|
������ |
|
|
������ |
|
|
������ |
|
|
������ |
| �����R�� |
|
�������A�c�ӎO�H |
| �c�x���N���� |
|
���{BCG |
�@
2013/9/17 �t�B�i���V�����E�^�C���Y
���o�N�V�[�����}���A�ėA�������~�߂�
�@�C���h�㔭����ŁA���O���q��Ђ̃����o�N�V�[�E���{���g���[�Y�̊�����30�����}�������B�ĐH�i���i�ǁi�e�c�`�j�����Ђɑ��ėA���x�����A�ꕔ���i�̗A���������~�߂�ӌ������������߂��B
�@
�@�e�c�`��13���A�����o�N�V�[�̃��n���H�ꂩ��o�ׂ���鐻�i�̗A���������~�߂�Ɣ��\�����B���H��̓X�C�X�̐�����m�o���e�B�X�̍������ǎ��Ö�u�f�B�I�o���v�̌㔭��Ȃǂ�č������ɐ��Y����\�肾�����B
�@�A���x���́A�e�c�`����Ƃ����̐��Y�{�݂ɂ��āA�u�K���Ȑ�����Ɋ�Â��ĉ^�c����Ă��Ȃ��v�Ɣ��f�����ꍇ�ɔ�������B
���T���ɕĐ��{�։ߋ��ő�̘a����
�@����̂e�c�`�̑[�u�́A��R�X�g�ł̌㔭�Y�ɓ������郉���o�N�V�[�ɂƂ��đ傫�ȒɎ�ƂȂ�B�܂��Ă⓯�Ђ͂T���ɊO���n�����ƂƂ��Ă͉ߋ��ő�̘a�����ƂȂ��T���h�����x�������ƂŕĐ��{�ƍ�����������ŁA�S�@��]��}���Ă������̂��Ƃ��B
�@�����o�N�V�[�͕s�����������������i�̔̔���A���Ј��̓�����������������2004�`07�N�ɓ��ǂɋ��U�̏�����Ă������ƂȂǂV���̈ᔽ��F�߂Ă����B
�@���O����08�N�ɓ��Ђ�47���h���Ŕ����B���̒���ɁA�e�c�`�̓����o�N�V�[�̂Q�H��ł̕i���Ǘ��̕s�����w�E���A���А��i�̗A�����֎~�����B���O���͔�������킸�����J�����38���h���̕]�������v��B����Ȍ�����Ђ̖��������ł����ɂ���B
�@�����o�N�V�[�̍L��S���҂́u�e�c�`���獡��̌��Ɋւ���A���͎Ă��Ȃ��v�Ɩ��炩�ɂ�����ŁA�e�c�`����́u����Ȃ�������߂Ă���v�ƌ�����B
�@�Č㔭��s��ł̃C���h��Ƃ̃V�F�A�͖�S���ɋy��ł���B
-----
FDA Sept. 16, 2013
FDA prohibits manufacture of FDA-regulated
drugs from Ranbaxy�fs Mohali, India, plant and issues import alert
Agency issues import alert and adds this facility to existing
consent decree
The U.S. Food and Drug Administration today issued an
import alert under which U.S. officials may detain
at the U.S. border drug products manufactured at Ranbaxy Laboratories,
Ltd.�fs facility in Mohali, India. The firm will
remain on the import alert until the company complies with U.S. drug
manufacturing requirements, known as current good manufacturing practices (CGMP).
�gThe FDA is committed to using the full extent of its enforcement authority to
ensure that drugs made for the U.S. market meet federally mandated quality
standards,�h said Howard Sklamberg, director of the Office of Compliance in the
FDA�fs Center for Drug Evaluation and Research. �gWe want American consumers to be
confident that the drugs they are taking are of the highest quality, and the FDA
will continue to work to prevent potentially unsafe products from entering the
country.�h
The FDA also ordered that the Mohali facility be subject to certain terms of the
consent decree of permanent injunction entered against Ranbaxy in January 2012.
The decree contains provisions to ensure CGMP compliance at certain Ranbaxy
facilities, including in Paonta Sahib and Dewas, India, as well as provisions
addressing data integrity issues at those two facilities. Ranbaxy�fs Paonta Sahib
and Dewas facilities have been on FDA import alert since 2008.
The FDA exercised its authority under a provision in the consent decree
permitting it to order that terms of the decree be extended to a Ranbaxy-owned
or operated facility if an inspection determines that the facility is in
violation of Federal Food, Drug, and Cosmetic Act or FDA regulations, including
CGMP. CGMP requirements serve as the primary regulatory safeguard over drug
manufacturing and must be followed by companies to ensure manufacturing quality.
In September and December 2012, FDA inspections identified
significant CGMP violations at Ranbaxy�fs Mohali facility, including
failure to adequately investigate manufacturing problems and failure to
establish adequate procedures to ensure manufacturing quality.
Under the decree, Ranbaxy is prohibited from manufacturing FDA-regulated drugs
at the Mohali facility and introducing drugs into interstate commerce, including
into the United States, from the Mohali facility until the firm�fs methods,
facilities, and controls used to manufacture drugs at the Mohali facility are
established, operated, and administered in compliance with CGMP. Ranbaxy is
required to hire a third-party expert to conduct a thorough inspection of the
Mohali facility and certify to the FDA that the facilities, methods, processes,
and controls are adequate to ensure continuous compliance with CGMP. Once the
agency is satisfied that Ranbaxy has come into compliance with CGMP, Ranbaxy
will be permitted to resume manufacturing and distribution of FDA-regulated
drugs at the Mohali facility.
The agency does not anticipate that this action will cause a supply disruption
or shortage of drugs in the United States.
The FDA recommends that patients not disrupt their drug therapy because this
could jeopardize their health. Individuals who are concerned about their
medications should talk with their health care professional.
�@
2014 �N4 ��7 �� ���O��
�T���E�t�@�[�}�Ɠ��Ўq��Ђ̃����o�N�V�[�̍����Ɋւ��邨�m�点
���O���́ASun Pharmaceutical Industries Ltd.(�{�ЁF�C���h �}�n�[���[�V���g���B �����o�C)
�����������i�����䗦�F�����o�N�V�[�̊����P�ɑ��A�T���E�t�@�[�}�̊���0.8
�j�ɂ�胉���o�N�V�[���z���������邱�Ƃ��T���E�t�@�[�}�Ƃ̊Ԃō��ӂ��܂����̂ł��m�点���܂��B
�{�����Ɋւ���_�T���E�t�@�[�}�ƃ����o�N�V�[�Ƃ̊ԂŒ������ꂽ���Ƃ��A�{�����Ђ�蔭�\����܂����B���݁A���Ђ̓����o�N�V�[�̊����̖�63.4
����ۗL���Ă���܂����A���̍����ɂ��A�T���E�t�@�[�}�̊����̂�����9�����擾���A�����1 ����h�����錠����L���邱�ƂƂȂ�܂��B
�Ȃ��{�����́A���Ђ̊���Ȃ�тɋK�����ǂ̏��F����т��̑��K�v�Ȏ葱���̏I����A2014�N12
�������Ɋ�������\��ł��B�܂��A�{���ɂ��A���Ђ̋Ɛтւ̉e���́A�ڍׂ��m�肵����A���₩�ɂ��m�点�������܂��B
������A�T���E�t�@�[�}�́A���E�s��ɂ����đ�5
�ʂ̃W�F�l���b�N��ƂƂȂ�A�C���h�s��ɂ����ẮA�����ő�̐����ƂƂȂ�܂��B���Ђ͍���A�T���E�t�@�[�}�Ƃ̃p�[�g�i�[�V�b�v��ʂ��A�n�C�u���b�h�r�W�l�X�̍X�Ȃ�i�W��}���ĎQ��܂��B
���� Sun Pharmaceutical Industries Ltd.
�{�Џ��ݒn �C���h �}�n�[���[�V���g���B �����o�C
�ݗ� 1983 �N
2013 �N3 �����Ɛ�
���㍂ 112.3 Bil.��߰ �i1,932 ���~�j
EBITDA 49.1 Bil.��߰ �i845 ���~�j
�����v 30.1 Bil.��߰ �i518 ���~�j
�����Y 149.8 Bil.��߰ �i2,577 ���~�j
�L���q���� 2.0 Bil.��߰ �i34 ���~�j �i1 ��߰=1.72 �~�j
�]�ƈ��� ��14,000 �l
���_ �H�� 26 ���� �i�C���h11�A�č�7�A���̑�8�j
������4 ����
Sun Pharmaceutical
�̓C���h�̃����o�C�ɖ{�Ђ�u���W�F�l���b�N���[�J�[�B
1983�N�ɐݗ���AICN�̃n���K���[���ƁACaraco
Pharmaceutical�ATaro Pharmaceutical �Ȃǂ̔����AMSD�iMerck�j�Ƃ�JV�ݗ��Ȃǂ��g��A�W�F�l���b�N���i��m�[�u�����h���i�𒆐S�ɃA�����J���O����[���b�p����уA�W�A�Ȃǐ��E���ɗA�o���Ă���B
���c��i��2012�N��URL Pharma���������A���̌㓯�Ђ̌㔭�i���Ƃ�Sun�ɔ��p���Ă���B
���c��i��URL Pharma��2012�N4���A���c��URL Pharma��800�S���ăh���Ŕ������邱�Ƃɂ��č��ӂ����B����������A���c�t�@�[�}�V���[�e�B�J���YUSA�ɓ��������B
URL Pharma��2011�N�̔��㍂�͖�600�S���ăh���ŁA���̂����ɕ��̗\�h����ю��Ö�ł���Colcrys�̔��㍂��430�S���ăh�������߂Ă���B
���c��i��2012�N12���AURL Pharma�̌㔭�i���Ƃ�Sun
Pharma��100%�q��Ђ�Caraco Pharmaceutical �ɏ��n�����B
���c��i��6��13���A�C�X���G����Teva Pharmaceutical
�ƃC���h��Sun Pharmaceutical �̗��ЂƘa�������Ɣ��\�����B
2013/6/19
���c��i�A�č��ł̈��i�����N�Q�i�ׂŘa���A�A���a�����͎��v�ɂȂ炸
�č�Ambit Biosciences�Ђ̔����Ɋւ��邨�m�点
���O����Ambit
Biosciences�Ђ́A���Ђ��V���ɐݗ�����q��Ђ�ʂ��āA���J���t�ɂ��AAmbit�Ђ̑S�����擾�ɂ���Ɣ������s�Ȃ����Ƃɍ��ӂ��܂����̂ł��m�点�������܂��B
Ambit�Ђ��L�i�[�[�j�Q�܂̑n��E�J���Ɍg���o�C�I�x���`���[��Ƃł���A���ݑ�3���Տ������i�K�ɂ���}�������������a���Ö�i��ʖ��F�L�U���`�j�u�A�J���R�[�h�FAC220)���Ȃǂ̉�������L���Ă���܂��B���Ђ͊��̈�ɂ����ĉ���I���Ö����邱�Ƃ𒆒����I�ȖڕW�ƒ�߂Ă���A�{�����ɂ��A���̈�ɂ�����|�[�g�t�H���I�����ɂȂ��ĎQ��܂��B
���Ђ́AAmbit�Ђ̔��s�ς̑S�����A�V���\�A�������g���̑Ή��Ƃ��Ė�315�S���ăh���i1��15�ăh���j�Y�����A�V���\�A�������g���̏��L�҂Ɏx�����܂��B�܂��A�����L�҂́A�����lj���AC220�̊J���}�C���X�g�[���ɉ������Ή�����錠�����L���A���킹�čő�410�S���ăh���̎x�����ƂȂ�܂��B
�Ȃ��A�{���Ɋւ���2015�N3�����̋Ɛтւ̉e���͉��߂Ă��m�点���܂��B
���o��FLT3�`���V���L�i�[�[�j�Q��BFLT3�͌����̂��ƂƂȂ錌�t���זE�E�O��זE�ɔ������Ă���`���ŁA�זE�̐�����B�Ɋ֗^���Ă��܂��B�}�������������a�̖�3����1��FLT3�̊������ψق��F�߂��Ă��܂��B
�� Ambit Biosciences�Ђ̊T�v���@
1.�В� �FMichael A.
Martino�iCEO, President and Member of the Board of Directors�j
2.���ݒn �F�č��J���t�H���j�A�B�T���f�B�G�S
3.�ݗ� �F2000�N
4.�������J �F2013�N5���iNASDAQ�j
5.���� �F8.20�ăh���i2014�N9��26���j�������z�F148�S���ăh��
6.���Ɠ��e�@�@�@�F�L�i�[�[�j�Q��̑n��A�J���Ɍg���o�C�I�x���`���[
7.�]�ƈ����@�@�@�F53�l�i2014�N9���j
ENHERTU®�i�g���X�c�Y�}�u
�f���N�X�e�J���j�̕č��ɂ�����̔����F�擾�̂��m�点
���O���ƃA�X�g���[�l�J�́AENHERTU®�i�g���X�c�Y�}�u
�f���N�X�e�J���AHER2�ɑ���R�̖����́iADC�j�j�ɂ��āA�č��H�i���i�ǁi�uFDA�v�j���u�]�ڐ��̓�����ɑ��鎡�ÂƂ���2�ȏ�̍RHER2�Ö@����HER2�z���̎�p�s�\���͓]�ڐ�������v��K���Ƃ��Ĕ̔����F���擾���܂����̂ŁA���m�点�������܂��B
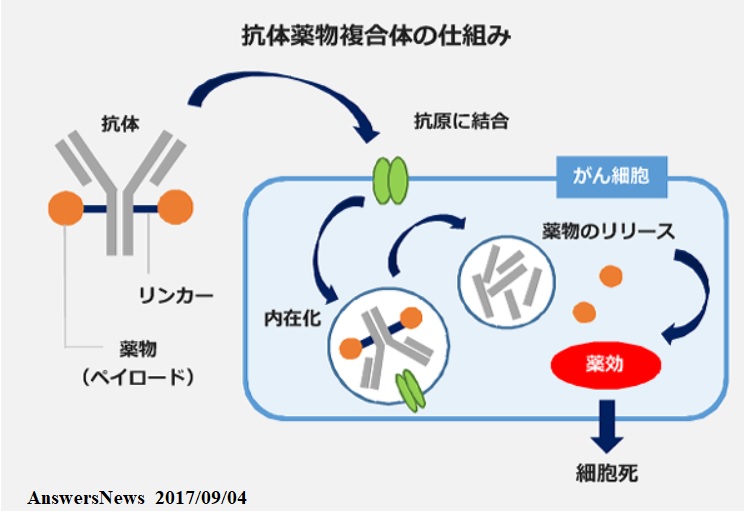
�R�̖����́iADC�j�Ƃ́A�R�̂Ɩi�ᕪ�q�������j��K�ȃ����J�[����Č�����������܂ŁA����זE�ɔ������Ă���W�I���q�Ɍ�������R�̂���Ė�����זE�֒��ړ͂��邱�ƂŁA�̑S�g���I��}������זE�ւ̍U���͂����߂Ă��܂��B
������Ȃǂɂ́A�זE�̕\�ʂɁA����זE�Ɂu���B����v�Ƃ����w�߂��o���uHER2�^���p�N�v�������Ă�����̂����邪�A�g���X�c�Y�}�u�́AHER2�^���p�N�̓������u���b�N���C����זE�̑��B��}����
�B
�{�K���́AT-DM1���Â���HER2�z���̍Ĕ��E�]�ڐ��������ΏۂƂ����O���[�o����2���Տ������iDESTINY-Breast01�j�̑t��������ёt�����Ԃ̌��ʂɊ�Â��A�v���R���̂��Ƃŏ��F����܂����B�{�K���ł̏��F�擾�͏����t���ł���AHER2�z���̍Ĕ��E�]�ڐ��������ΏۂƂ�����3���Տ������ɂ�����Տ��I�L�p���̌����K�v�ƂȂ�܂��B�Ȃ��A�{�܂ɂ��ẮA2019�N10����FDA��菳�F�\��������Ă���܂����B
�{�܂́A���㐔�T�Ԉȓ��ɕč��ɂĔ̔����J�n�������܂��B�Ȃ��A�{�܂̕č��Y�t�����ɂ́u�g�g�x���v�Ƃ��ĊԎ����x�����iILD�j�Ƒَ��Ő����L�ڂ���Ă��܂��B
���Ђ́A2025�N�܂łɂ���̈��7�̊v�V�I�V��̏�s��ڎw���Ă���A�{�܂�3�Ԗڂ̏��F�擾�i�ڂƂȂ�܂��B���Ђ́A�{�܂�ʂ��āA���Âɂ�����V���ȑI��������邱�ƂŁA���҂���ɍv���ł�����̂Ɗ��҂��Ă���܂��B
���ЂƃA�X�g���[�l�J�́A2019�N3���ɑS���E�i���Ђ��Ɛ�I������L������{�͏����j�ɂ����ăg���X�c�Y�}�u
�f���N�X�e�J���iDS-8201�j�������ŊJ���y�я��Ɖ�����_���������܂����B�Ȃ��A���Ђ͖{�܂̐����y�ы����ɐӔC�������܂��B
2019/4/1�@���O���A�R����܂�AstraZeneca�Ɛ헪�I��g�A�ő��69���h�����
�@
2025/12/3�@���O���@
����ADC���i�Ɋւ���Seagen�ЂƂ̓����W���̔����Ɋւ��邨�m�点
���O���́ASeagen
Inc.���e�L�T�X�B�����n��A�M�n���ٔ����œ��Ђɑ��Ē�N�����č�����10,808,039�i�u�f039�����v�j�Ɋ�Â��������N�Q�i�ׂ̍T�i�R�ɂ����āA2025�N12��2���A�č��A�M�����T�i�ٔ������f039�����͖����ł���Ƃ��ăe�L�T�X�n�ق̈�R�����������������������܂����̂ŁA���m�点�������܂��B
2023�N10��17���̈�R�����ł́A�f039�����͗L���ł���Ɣ��f����A���Ђ́A�����N�Q�Ɋ�Â����Q���������2022�N4��1������f039��������������2024�N11��4���܂ł�ENHERTU
®�̕č�����ɑ��郍�C�����e�B�̎x���𖽂����܂����B���Ђ͈�R�����ɑ��čT�i���N���Ă��܂����B
�܂��A��L�T�i�R�����Łf039 �����͖����ł���Ɣ��f���ꂽ���Ƃɔ����A���Ђ��č��������W���ɐ��������f039 �����ɑ�������t�^�ヌ�r���[�iPost
Grant Review�A�uPGR�v�j�̍T�i�R�ɂ����āA2025 �N12 ��2 ���i���n���ԁj�A�č��A�M�����T�i�ٔ����́ASeagen
�Ђ̍T�i�����p���锻���������܂����B2024 �N 1 �� 16 ���� PGR ����ɂ��f039 �����͖����Ƃ���ASeagen �Ђ� PGR
����ɑ��čT�i���N���Ă��܂����B
2022/8/16
���O�����R�̖������Z�p�Ɋւ���
Seagen Inc.�Ƃ̕���
�@
���O���́A2008�N7������Seattle
Genetics, Inc.�i���݂�Seagen�j���R�̖����́i�uADC�v�j���������������{�������A�V��J���̐��ʂ��łȂ��Ƃ���2015�N6�����W���������Ă����B
2019�N��Seattle
Genetics������O����ADC�i�Ɋւ�������̒m�I���Y���̋A�����咣���Ĉًc�̒ʒm���������B�������AADC�̋��������͌��݂̑��O����ADC�i�Ƃ͑S���قȂ����߁A���Ђ̎咣�͍������Ȃ��ƍl���Ă���A�f���E�F�A�B�A�M�n���ٔ����ɓ��Ђ�퍐�Ƃ��Ċm�F�i�ׂ��N�����o�܂�����B
2022/4/13
���O���̍R����܂ɕĘA�M�n�قŔ��R���u�����N�Q�v
�@
�@
���O����12���R���A���Ђ̍R�̖����́iADC�j�Z�p���߂����Seagen�Ђ���N���������N�Q�i�ׂ̍T�i�R�ŁA�č��A�M�����T�i�ٔ�������R�������������t�]�������������Ɣ��\�����B
����̍T�i�R�̓e�L�T�X�B�����n��A�M�n���ٔ����Œ�N���Ă������́B���Ђ́A�u�č��A�M�����T�i�ٔ����ɂ�鍡��̔����������]������v�ƃR�����g�����B
�@
ADC�Z�p���߂�������i�ׂ́ASeagen�Ђ���N����2023�N10��17���̈�R�����ŁA�������u�f039�����v�i�č�����10,808,039�j�͗L���ł���Ɣ��f�����A
���O���́A�����N�Q�Ɋ�Â����Q���������22�N4��1������f039��������������24�N11��4���܂ł̃G���n�[�c�̕č�����ɑ������C�����e�B�̎x���𖽂����Ă����B����ɓ��Ђ͈�R�����ɍT�i���N���Ă����B
����̍T�i�R�����Łu�f039�����v�͖����ł���Ɣ��f���ꂽ���Ƃɔ����A
���O�����č��������W���ɐ��������f039
�����ɑ�������t�^�ヌ�r���[�iPRG�j�̍T�i�R�ɂ����Ă��A�č��A�M�����T�i�ٔ����͓����A��Seagen�Ђ̍T�i�����p���锻�����������B
�@
�@
�@
�@
�@
