・アストラゼネカは、第一三共に対し、最大で総額69億米ドルの対価を支払います。このうち13.5億米ドルは契約一時金、55.5億米ドルは開発・販売の進捗等に応じて支払われます。
・日本を除く全世界における利益と開発・販売等費用を両社で折半します。売上収益は、 日米欧等においては第一三共が計上し、中国、オーストラリア、カナダ等においてはアストラゼネカが計上します。
第一三共は、当社が保有するトラスツズマブ デルクステカン([fam-] trastuzumab deruxtecan)について、乳がん、胃がん、非小細胞肺がん及び大腸がんを含むHER2発現がんを対象としたグローバルな開発及び商業化契約をアストラゼネカと締結しましたので、お知らせいたします。
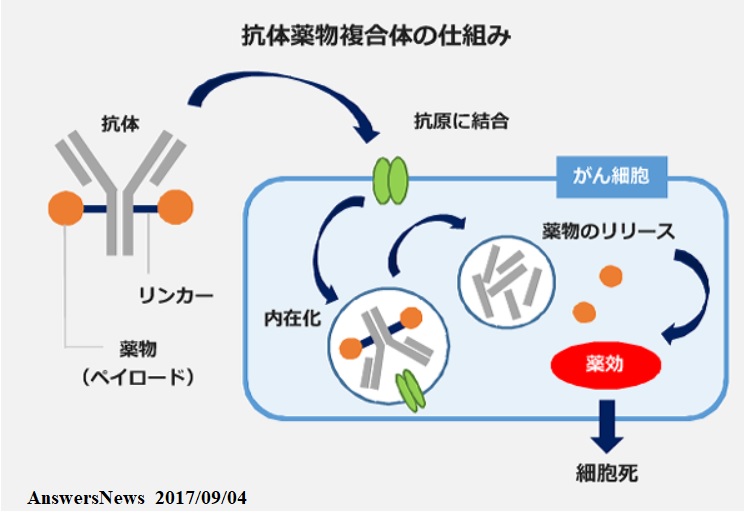
トラスツズマブ デルクステカン(DS-8201) はHER2に対する抗体薬物複合体(antibody drug conjugate: ADC)
抗体薬物複合体(ADC)とは、抗体と薬物(低分子化合物)を適切なリンカーを介して結合させた薬剤で、がん細胞に発現している標的因子に結合する抗体を介して薬物をがん細胞へ直接届けることで、薬物の全身曝露を抑えつつがん細胞への攻撃力を高めています。本剤は、独自のリンカーを介して新規のトポイソメラーゼI 阻害剤(薬物)を抗HER2抗体に結合させた薬剤。
乳がんの中には,その細胞の表面に「HER2タンパク」をもっているものがある。「HER2タンパク」は,がん細胞に「増殖しろ」という指令を出している。
トラスツズマブやペルツズマブなどは,HER2タンパクの働きをブロックし,がん細胞の増殖を抑える薬で,この治療法を「抗HER2療法」という。
当社とアストラゼネカは、全世界(当社が独占的権利を有する日本は除く)において、本剤の単剤療法及び併用療法を共同で開発し、商業化します。当社は本剤の製造及び供給に責任を持ちます。
本契約の下、アストラゼネカは当社に13.5億米ドルの契約一時金を支払います。また、当社は、開発マイルストンの達成等により最大38億米ドル、販売マイルストンの達成により最大17.5億米ドルを受け取ります。すべての開発及び販売マイルストン等が達成された場合、支払総額は最大69億米ドルとなります。
本剤の全世界(当社が独占的権利を有する日本は除く)における利益と開発・販売等費用は、両社で折半します。本剤の売上収益は、日本、米国、当社が拠点を有する欧州及びその他地域の複数国においては当社が計上し、中国、オーストラリア、カナダ、ロシア及びその他地域においてはアストラゼネカが計上します。
第一三共の代表取締役会長 兼 CEOの中山 讓治は、「トラスツズマブ デルクステカン(DS-8201)は、第一三共の強みであるサイエンス・テクノロジーによって創製されたがん領域のフラッグシップ アセットです。がん事業のグローバル展開に豊富な経験とノウハウを持つアストラゼネカとの戦略的提携を通じて、自社単独ではなし得ない規模の資源を投下し、本剤の価値を最大化すると共に、グローバルながん事業体制の構築を加速します。幅広い種類のがんにおいて新たな治療の選択肢を一日も早く提供することで、世界中のがん患者さんとそのご家族に最大限貢献してまいります。」と述べています。
アストラゼネカの最高経営責任者(CEO)のPascal Soriot(パスカル・ソリオ)は、「トラスツズマブ デルクステカン(DS-8201)は、HER2陽性乳がん及び胃がん治療に変革をもたらす新薬になり得ると考えています。また、HER2低発現乳がんにおけるファーストインクラスとして乳がん治療を再定義する可能性があります。さらに、本剤は、肺がんと大腸がんを含む他のHER2変異・HER2過剰発現がんにおいて、抗HER2療法の恩恵を受ける患者さんの対象を広げる可能性があります。他の疾患領域においても長期的に協業している第一三共と今回提携することを誇りに思います。」と述べています。
当社が受け取る契約一時金13.5億米ドルは、契約上の履行義務が存在する期間にわたって売上収益に計上するため、当社の2019年3月期の連結業績に与える影響は軽微です。本提携は、当社の中長期的な企業価値・株主価値の向上に貢献することが期待されます。
トラスツズマブデルクステカン(DS-8201)について
トラスツズマブ デルクステカン(DS-8201、以下「本剤」)は、第一三共のantibody drug
conjugate(ADC)フランチャイズにおける主力品目です。
本剤は、第一三共独自のADC技術を用いて創製され、独自のリンカーを介して新規のトポイソメラーゼI阻害剤(薬物)を抗HER2抗体に結合させた薬剤です。薬物をがん細胞内に直接届けることで、薬物の全身曝露を抑えるよう設計されています。
北米、欧州及び日本を含むアジアにおいて、本剤を用いた広範かつ包括的な臨床試験が進行中です。HER2低発現乳がんを対象に本剤と治験医師選択薬を比較する第3相臨床試験(DESTINY-Breast04)、HER2陽性乳がんを対象に本剤とT-DM1を比較する第3相臨床試験 (DESTINY-Breast03)、HER2陽性乳がんを対象に本剤とT-DM1治療後の治験医師選択薬を比較する第3相臨床試験(DESTINY-Breast02)、HER2陽性乳がんを対象とした本剤の第2相臨床試験(DESTINY-Breast01)、HER2陽性胃がんを対象とした本剤の第2相臨床試験(DESTINY-Gastric01)を実施中です。また、HER2発現の大腸がんを対象とした本剤の第2相臨床試験、HER2過剰発現及びHER2変異を有する非小細胞肺がんを対象とした本剤の第2相臨床試験、HER2発現乳がん及び膀胱がんを対象に本剤とニボルマブの併用療法を評価する第1相臨床試験、HER2発現の複数がんを対象とした本剤の第1相臨床試験を実施中です。
本剤は、米国食品医薬品局(FDA)より、HER2陽性の再発・転移性乳がん治療を対象として画期的治療薬(Breakthrough Therapy)指定及びファストトラック指定を受けています。また、HER2過剰発現の進行・再発胃がん治療を対象として厚生労働省より先駆け審査指定を受けています。
本剤は、いずれの国においても、またいずれの適応症においても承認されていない治験薬で、安全性及び有効性は確定しておりません。