大日本住友製薬 → 住友ファーマ
明治19年(1886)に日本薬局方が公布されたものの、局方に適合する薬品を製造する製薬所を個人で創設することは、当時では無理であったので、国庫の補助を
仰ぎ、ドイツに留学中のドクトル・長井長義を製薬長として、明治18年、東京木挽町に大日本製薬会社が設立されました。
一方、大阪・道修町の有力薬業家において、先に大阪薬品試験会社が設立されていましたが、明治23年(1890)には武田、田辺、塩野義の三商店の共同出資によ
り、ヨード製造を目的とする「広業舎」を設立して、舶来品に劣らない品質のものを製造しました。
さらに、旧来の伝統を有する道修町薬業の総意を結集して、大阪の地に近代的な製薬所を設立し、純良医薬品を提供するため、明治30年(1897)、日野九郎兵衛、
田辺五兵衛、小野市兵衛、武田長兵衞、谷山伊兵衛を役員として「大阪製薬株式会社」が設立され、近代製薬事業の第一歩を踏み出しました。
同社は明治31年(1899)に半官半民で経営難に陥っていた東京の大日本製薬会社を吸収合併して「大日本製薬株式会社」となり、海老江の新鋭工場を軸としてア
ルコールほか主に局方品の製薬に邁進しました。
」
◆司薬場では、検査に合格した品質保証のため「司薬場検査済印紙」を貼付していました。
大阪司薬場は明治16年(1883) 衛生局大阪試験所と改称され、検査済印紙は「衛生局試験所検査之証」と変わりました。
明治22年(1889)『薬律』制定後、「自今衛生試験所において検査印紙を貼付するものは、日本薬局方所定の薬品に限る」とされました。
しかし実際に取扱われた薬品は、日本薬局方所定品でないものが多数あり、新薬品が続々と海外から輸入される時代となると、営業上に支障を来たすことが
生じました。
そこで、日本薬局方はもちろん、各国薬局方収載薬品のいずれにも記載していない新薬品などの試験をするため、大阪薬種卸仲買商組合は有力者14名を
発起人として明治21年(1888)大阪薬品試験会社を設立、その検査済み印紙は、官立の大阪衛生試験所の検査印紙に匹敵すると評価されました。
大阪薬品試験会社は、明治41年(1908)大日本製薬株式会社に合併され、その事業は同社の「試験部」として引き継がれました。
明治30年(1897)前後、大阪製薬業界では大日本製薬株式会社の発足があったほか、中藤昇平、岩井松之助、小西利七、石濱豊蔵、内林直吉、小西久兵衛、
蓮井宗吉、須賀磯八、小野市兵衛、黒石卯之助らが、小規模ながら局方品製造に挑んでいました。
同34年の「重要物産組合法」により「大阪製薬同業組合」を設立する動きが出て、石濱豊蔵、小西利七、小西久兵衛が発起人となり、明治35年に設立を
認可されました。
初代総取締は石濱豊蔵、組合事務所は当初、東区伏見町二丁目中橋筋東入北側に置かれました。
ここにおいて江戸時代の薬種薬種中買仲間の伝統を受け継ぐ道修町の同業組合は、流通面の「大阪薬種卸仲買商組合」と、製薬面の「大阪製薬同業組合」と
に分かれたわけです。
そして製薬同業組合の流れは、戦後の「大阪医薬品協会」に引き継がれています。
社長 日野九郎兵衛
取締役
田邊 五兵衛 田邊五兵衛商店→田辺製薬
塩野 義三郎 「塩野義三郎商店 塩野義製薬
宗田 反治郎
小磯 吉人 神戸市衛生局長
小西 久兵衛 道修町の薬種商
上村 長兵衛 上村工業株式会社
1848(嘉永元年)大阪道修町において、医薬品の販売を始める。
1915(大正4年)当時の最先端技術として日本に導入され始めためっき技術に、第6代上村長兵衛が着目し、めっき資材の輸入業に業種転換をはかり、日本市場での明確な地位を築く。
監査役 小野 市兵衛
享
保2年
初代小野市兵衛が道修町の現在地において、伏見屋市兵衛の屋号のもとに薬種仲買人として創業。
大正7年 東洋製薬化成㈱設立。(現・連結子会社)
昭和9年 資本金16万円の合名会社小野市兵衞商店に改組する。
昭和22年 商店の医薬品製造部門として日本有機化工株式会社(資本金19万5千円)、注射アンプル等医薬用硝子資材部門として日本理化学工業株式会社を設立して、資
材を含む医薬品の製造及
び販売の一貫作業を開始。 昭和23年
日本有機化工株式会社を現在名の小野薬品工業株式会社と改称し、日本理化学工業株式会社を解散する。
武田 長兵衛 武田長兵衛商店 武田薬品
谷山 伊兵衛 薬種問屋谷山伊兵衛商店
大阪
道修町の有力薬業家は、輸入薬の横行から脱却し純良薬品の提供を目指して、
明治29年9月、共同出資による近代的な製薬会社の設立を計画した。
発起人21名の中に、神戸市衛生局長 小磯吉人の名があり、翌年5月、大阪製薬株式
会社が発足、小磯氏は取締役の一人に選任された。
明治31年には、東京の大日本製薬合資会社を合併、大日本製薬株式会社と改称した。
小磯氏は常務取締役に就任、他の重役が自店の経営のため社務を顧みることが少ない
中にあって、日野九郎兵衛社長を助けて常務の責務を果たした。
大正4年、小磯氏は二代目社長に選任され、第一次世界大戦下、外国薬品の国産化に
尽力した。大正15年2月、死去。
小磯良平氏は、明治36年
神戸市の岸上家の8人兄弟の次男に生まれた。
大正14年、東京美術学校(現
東京芸術大学)4年在学中に実父 文吉が他界し、祖母の
甥である初代神戸市長
小寺謙吉氏を通じて、小磯家の養子に貰い受けたい話が起こ
った。
小磯吉人の妻
英(ひで)が謙吉の姉で、良平の祖母の姪であるという縁もあり、良平は
吉人の願いを承諾し、吉人の死後、小磯良平となる。
また、武田薬品工業株株式会社社長 六代目
武田長兵衞は、小磯良平の支援者として
有名である。
これは、武田家・小磯家ともに大阪製薬株式会社の発起人であり、役員であったことに由来
しており、画伯の多くの名品の所蔵者として長く交友を続けた。
ーーーーーーーーーーーーーーーーーー
古代医学の巨人はローマのガレン(Gelenus AD130~201年)でしょう。ガレンは実験医学の創始者であり、ヒポクラテス以後の古代医学において最も有名な医学者でもあります。彼はその死後15世紀もの間、西洋の医学に大きな影響をあたえ続けました。
彼の最も大きな功績のひとつは、血管には血液が流れていると考えたことでした。ガレン以前の医学では血管には空気は流れていると考えられていまし
た。また、ガレンは心臓が普通の骨格筋とは異なった特徴をもっていることを発見し、意志の力とは無関係に作動する筋肉(不随意筋)で出来ていることを明ら
かにしました。
ガレンは先人が残した書物を検討し、研究したうえで自らも学説を打ち出し、薬を『特殊薬・毒薬・解毒薬』に3分類しました。
また、自然治癒力を重視しながらも、それだけでは病気を治すことは出来ないとし、当時使われていた生薬を病気別に分類し、調剤しました。原
料となる生薬はガレン薬と呼ばれ、ガレンが処方した製剤はガレヌス製剤と呼ばれていました。ガレヌス製剤には現在でも使われているものがあり、コールドク
リームなども彼の工夫によるものといわれています。
抽出製剤とは、溶剤を用い生薬の無効不用の部分を実際上支障のない程度に除き、有効又は有用な成分のみを取り出し使用に便利な剤形にしたもの。ガレヌス製剤ともいう。
2012年7月27日
大日本住友製薬と日東電工が共同開発 2012/8/2
大日本住友製薬と日東電工、世界初の統合失調症治療用テープ製剤を共同開発
世界初の統合失調症治療用テープ製剤の第Ⅱ相試験に着手
大日本住友製薬と日東電工は、経皮吸収による統合失調症治療剤として、非定型抗精神病薬「ロナセン®」(一般名:ブロナンセリン)のテープ製剤の第Ⅱ相試験に着手いたしましたのでお知らせします。
健康成人を対象に実施した第Ⅰ相試験において、テープ製剤の単回および反復投与によりブロナンセリンの良好な経皮吸収性を確認することができました。この結果を受けて両社は、最適な貼付条件を検討するため患者さんを対象にした第Ⅱ相試験を開始いたしました。
世界初となる統合失調症治療用テープ製剤の実用化に向け、患者さんやご家族、介護者の皆さまのご期待に応えられるよう、両社は迅速な開発に取り組んでまいります。
(ご参考)
<テープ製剤の一般的な特長>
・ 投薬期間中安定した血中濃度を維持することができる。また食事の影響を受けにくい。
・ 経口投与が困難もしくは経口投与を希望されない患者さんに新たな治療の選択肢を提供する。
・ 投薬状況を視覚的に確認できる。
<共同開発の背景>
大日本住友製薬は、数多くの医療用医薬品を開発しており、2008 年4
月より統合失調症治療の経口剤(錠剤および散剤)として、ロナセン®を国内で販売しています。また日東電工は、様々な薬物を皮膚から吸収させ、体内に導く経皮吸収治療システムとして、経皮吸収型テープ製剤設計の技術を確立しています。両社の医薬品と製剤技術を融合させ、統合失調症治療用として経皮吸収型テープ製剤の共同開発を2010
年より行っています。
<ロナセン®とは>
ロナセン®は、統合失調症の陽性症状(幻覚、妄想など)のみならず、陰性症状(情動の平板化、意欲低下など)に対する改善効果を示すことが臨床試験にて示されています。また、錐体外路症状の発現率は低く、体重増加や高プロラクチン血症等の副作用も少ないことが示されています。
<統合失調症とは>
統合失調症とは精神疾患の一つで、国内では約80
万人が罹患しているといわれています。統合失調症の発症には、中脳-辺縁系や中脳-皮質のドパミン神経が関連していると考えられ、幻覚・妄想などの陽性症状、情動の平板化/思考の貧困/意欲の低下などの陰性症状、および注意力低下/情報処理能力障害などの認知機能障害等、様々な精神症状が現れることが知られています。
ーーーー
日東電工 医薬品 経皮吸収型テープ製剤
薬を皮膚から吸収させ、体内に導く経皮吸収治療システム。
貼って治す薬物投与方法として内服薬、注射剤などにない数々の利便性を備えています。内服薬のように消化管や肝臓などに負担をかけず、注射剤のように針の侵入に伴う痛みがなく、また薬物の投与量をコントロールして一時的な過度の薬物吸収による副作用を軽減できることなどから、患者さんの不安・負担を和らげることができます。効果の持続性にすぐれ、投与(貼付)が目で確認できることから、確実な治療効果が期待できます。
日東電工では1970年代後半から、世界に先駆けて経皮吸収型テープ製剤の開発に取り組んだ結果、コントロールドリリースに最適な粘着剤合成をはじめ、安全性・安定性にすぐれた製剤設計の技術を確立しました。今後も各種薬剤の経皮吸収治療システムを通じて、
QOL(Quality Of Life)の向上に努めていきます。
虚血性心疾患治療用テープ製剤
狭心症など虚血性心疾患治療に用いる、硝酸イソソルビドを粘着剤中に含む経皮吸収型医薬品です。胸部、上腹部などに貼ることで独自の結晶レジボアシステムから放出された薬剤により、安定した心臓機能の改善がもたらされます。このテープ製剤は、油性ゲル粘着剤を応用することにより、皮膚への“やさしさ”にも配慮しており、使いやすい“貼る心臓薬”
として医療現場で高い評価を受けています。
喘息治療用テープ製剤
気管支喘息など喘息治療に用いるツロブテロールを粘着剤中に含む世界で初めての経皮吸収型・気管支拡張剤です。一般に呼吸機能にはサーカディアンリズムがあり、1日のうち深夜から早朝にかけて低下することが知られています。このテープ製剤は、この生体の持つリズムに合わせ「必要な時に必要な量を送達する」という時間薬物治療の考えに基づく製剤で、持続性にすぐれた気管支拡張作用を示します。
局所麻酔用テープ製剤
皮膚を麻酔するテープ製剤です。静脈留置針を皮膚に刺す際の疼痛を和らげます。注射による痛みは不安を一層ひろげ定期的な加療での痛みは憂鬱さを感じるだけで医療行為に決してプラスにはなりません。このテープ製剤は、局所麻酔剤を経皮的に皮膚内へ高濃度に移行させる技術により“貼る麻酔薬”を実現しました。
経皮吸収型テープ製剤技術開発のポイント

※これら医薬品の使用にあたっては、医師の処方箋が必要です。
2018年7月31日
↑
大日本住友製薬/日東電工
非定型抗精神病薬「ロナセン®」テープ製剤の製造販売承認申請について
大日本住友製薬株式会社(本社:大阪市、代表取締役社長:野村
博、以下「大日本住友製薬」)は、日東電工株式会社(本社:大阪市、代表取締役社長:髙﨑
秀雄、以下「Nitto」)と共同開発中の、非定型抗精神病薬「ロナセン®」(一般名:ブロナンセリン)テープ製剤(以下「本剤」)について、国内における製造販売承認申請を行いましたので、お知らせします。
「ロナセン®」は、大日本住友製薬が創製した経口の非定型抗精神病薬であり、統合失調症を適応症として 2008
年4月より国内で販売されています。「ロナセン®」の薬物動態の更なる安定化を図るため、大日本住友製薬は、経皮吸収型テープ製剤の設計技術を有する
Nitto と、2010 年より共同開発を進めてきました。
本剤は 1日1回、皮膚に貼付することにより 24
時間安定した血中濃度を維持できるため、良好な有効性および安全性が期待できます。また、テープ製剤の特徴から、投薬中であることを視認できるメリットに加え、食事の影響を受けにくいことから、食生活が不規則な患者さんや経口服薬が困難(嚥下困難等)な患者さんへも投与可能な製剤です。
本剤が承認されれば、両社は統合失調症に対する新たな投与経路を持つ治療選択肢を提供することができます。これにより Shared Decision
Making(SDM:患者さんと医療者等が共同で治療方針の意思決定を行うこと)の推進および服薬アドヒアランスの向上に寄与し、社会機能の回復をめざす統合失調症の治療に貢献できるものと期待しています。
(ご参考)
【本剤のフェーズ3試験の概要】
試験は、日本を含む数か国で実施された多施設共同、ランダム化、プラセボ対照二重盲検比較フェーズ3試験であり、成人の統合失調症患者580名が、本剤40
mg/日投与群(196名)、本剤80mg/日投与群(194名)、プラセボ投与群(190名)に割り付けられました。本試験の結果、主要評価項目であるPANSS合計スコアの投与
6 週間後のベースラインからの変化量は、主要な解析対象集団 577 名では、本剤 40mg/日投与群および本剤 80
㎎/日投与群のいずれもプラセボ投与群に対し、統計学的に有意な改善を示しました。また、本剤は総じて良好な忍容性を示し、本剤投与群での有害事象は皮膚関連事象も含め全般的に軽度でした。
本試験の速報結果については、2018年2月14日に開示しています。
【「ロナセン®」について】
「ロナセン®」は、ドパミン D2/D3受容体およびセロトニン 5-HT2A
受容体に対する親和性を有しており、臨床試験において、統合失調症の陽性症状(幻覚、妄想など)のみならず、陰性症状(情動の平板化、意欲低下など)に対する改善作用が示されています。
↑
2019/6/18
大日本住友製薬/
日東電工
非定型抗精神病薬「ロナセンテープ」の製造販売承認取得について
大日本住友製薬は、日東電工と共同開発を行った非定型抗精神病薬「ロナセン®テープ20mg、30mg、40mg」(一般名:
ブロナンセリン)について、6月18日付けで
国内における製造販売承認を取得しましたので、お知らせします。
本剤は、世界で初めての抗精神病薬のテープ製剤であり、大日本住友製薬は薬価収載後に発売する予定です。
「ロナセン®錠/散」は、大日本住友製薬が創製した経口の非定型抗精神病薬であり、
統合失調症を適応症として2008年4月より国内で販売されています
。
ブロナンセリンの血中濃度推移の更なる安定化を図るため、
大日本住友製薬は、経皮吸収型テープ製剤の設計技術を有するNittoと、2010年より
共同開発を進め、2018年7月31日に製造販売承認申請を行いました。
本剤は1日1回、皮膚に貼付することにより24時間安定した血中濃度を維持できるため、良好な有効性および
安全性が期待でき
ます。
また、 テープ製剤の特長から、貼付の有無や投与量を視認できるメリットに加え、食事の影響を受けにくいことから、食生活が不規則な患者さんや経口服薬が困難(嚥下困難等)な患者さんへも投与可能な製剤です。
このたびの承認取得により、大日本住友製薬は、統合失調症に対する
新たな 投与経路を持つ治療選択肢を提供することで、Shared
Decision
Making(SDM:患者さんと医療者等が共同で治療方針の意思決定を行うこと)の推進および
服薬アドヒアランスの向上に寄与し、社会機能の回復をめざす統合失調症の治療に貢献できることを期待しています。
(ご参考)
【ロナセン®について】ロナセン®は、ドパミンD2、D3受容体およびセロトニン5-HT2A受容体に対する親和性を有しており、臨床試験において、統合失調症の陽性症状(幻覚、妄想など)のみならず、陰性症状(情動の平板化、意欲低下など)に対する改善作用が示されています。大日本住友製薬は現在、
錠剤および散剤を販売しており、テープ製剤の販売を準備中
2012/8/2
大日本住友製薬と日東電工、世界初の統合失調症治療用テープ製剤を共同開発
2012 年12 月27 日 神戸大学/神戸天然物化学/大日本住友製薬
Ras シグナルを標的とする新規抗がん剤候補化合物に関するライセンス契約および共同研究契約の締結のお知らせ
神戸大学、神戸天然物化学および大日本住友製薬は、このたび、神戸大学と神戸天然物化学とが共同で創製したRas
のシグナル伝達に関わる有望な化合物について、全世界を対象とした、開発、製造、販売に関する独占的なライセンス契約を締結しましたのでお知らせします。
本ライセンス契約に基づき、大日本住友製薬は、神戸大学および神戸天然物化学に、契約一時金、マイルストン及びロイヤリティを支払います。
また、神戸大学と大日本住友製薬は、本ライセンス契約の対象とは異なる新規なRas のシグナル伝達に関わる抗がん剤の創製を目的とした共同研究契約を締結しました。
神戸大学は独創的な創薬による社会貢献をめざして、医学研究科にて長年にわたり研究を継続すると共に、その成果のライセンスによる社会活用を目指してきました。
一方、神戸天然物化学は、有機合成技術力をベースに、提案型創薬化学事業を展開しています。
このたび、神戸大学は、ターゲットタンパク質の詳細な立体構造をX線結晶解析やNMR解析により決定し、その分子表面に創薬ターゲットとなる特異的ポケットが存在することを明らかにしました。
そのポケットを「鍵穴」として、それにはまり込むことによりタンパク質の機能を阻害する、いわば「鍵」となる化合物についての創薬研究を、神戸天然物化学と連携して実施しました。
両者は、構造情報に基づくコンピュータドッキングシミュレーションによるデザイン、合成アプローチ及び活性評価を駆使することによって、非臨床試験で有効性を示すリード化合物の創製に成功しました。
なお、本研究成果は独立行政法人医薬基盤研究所の委託研究及び厚生労働省科学研究費補助金による研究の一環で得られたものです。
大日本住友製薬は、アンメット・メディカル・ニーズの高い「がん」をチャレンジ領域と位置づけています。2012 年9
月に、がん領域の創薬研究に特化した、がん創薬研究所を新設し、新たなアプローチによる抗がん剤の創薬研究に注力しています。
大日本住友製薬は、本ライセンス契約の締結によりがん領域における開発パイプラインを強化することに加え、神戸大学との産学連携の共同研究により、革新的な新薬の創製を目指します。
【ご参考:用語解説】
Ras:Ras は、細胞増殖および分化に関係する細胞内情報伝達(シグナル)経路をコントロールする重要な因子として知られています。
X線結晶解析:X線照射時、多くはそのまま物質を突き抜けますが、一部のX線は、吸収されたり、散乱されたりします。X線結晶解析は、この散乱されたX線の情報から、物質の3次元構造を知る手法です。
NMR 解析:Nuclear Magnetic
Resonance(核磁気共鳴)の略。物質の構造情報測定法の一つで、スペクトル(成分情報)から物質の構造や量的な情報を得ることができます。
コンピュータドッキングシミュレーション:低分子(薬物やホルモンなど)と生体高分子(タンパク質や核酸などの複合体)の安定構造をコンピュータ上で計算的に推定する手法です。
ーーー
Rasタンパク質(Ras蛋白質、Rasサブファミリー、以下Rasと略す)は、低分子GTP結合タンパク質の一種で、転写や細胞増殖、細胞の運動性の獲得のほか、細胞死の抑制など数多くの現象に関わっている分子である。
Rasの異常は細胞のがん化に大きく関わるのでras遺伝子は原がん遺伝子の一種である。
ーーー
神戸大学 生化学・分子生物学講座の片岡徹教授は、
癌遺伝子産物の関わる細胞増殖シグナル伝達機構の解明を通じ、それを分子標的とした抗癌剤の開発を目指している。
特に、
(1)遺伝子改変マウスを用いたRas/Rapの標的蛋白質PLCεとRA-GEFの発癌における機能解析、
(2)Ras/Rap及びその標的蛋白質の高次構造解析とインシリコ創薬、
(3)RhoファミリーG蛋白質の調節機構と細胞内機能の解析
を行っている。
in silico(イン・シリコ)は、実際の意味は「コンピュータを用いて」
独立行政法人医薬基盤研究所の2006年度「保健医療分野における基礎研究推進事業」に下記が採用されている。
研究プロジェクト名 Rasとその支配するシグナル伝達系の機能阻害を分子標的とした抗癌剤の開発
研究概要
rasはヒトの発癌に関わる最も普遍的な癌遺伝子であり、その産物Ras蛋白質は抗癌剤開発の最も有効な分子標的である。
Rasの機能阻害を目指した抗癌剤の開発には、未だ成功例はない。
本研究では、①Rasの新たに解明された高次構造の特徴に着目したRas自身の活性阻害、②発癌に関与するRas標的蛋白質ホスホリパーゼCe
(PLCe))
の活性阻害、③Rasと標的蛋白質Rafとの結合の選択的阻害、を分子標的とし、in
silico創薬技術及び生化学・細胞生物学的手法を駆使して、独自の多面的アプローチにより抗癌剤開発を行う。
ーーー
神戸天然物化学は1985年創業で、有機化合物の受託研究、受託製造・分離精製及び技術開発を業とする。
上海の近郊の太倉市の化学工場専用開発区に全額出資の大神医薬化工(太倉)有限公司を持つ。
2013 年11 月8 日
新規結核ワクチンの共同開発に向けた基本合意のお知らせ
独立行政法人医薬基盤研究所、NPO 法人 Aeras(本部:米国メリーランド州、代表:トーマス・G・エバンス)およびクリエイトワクチンの三者は、このほど、ヒトパラインフルエンザ(Human
parainfluenza viruses : HPIVs ) 2
型ウイルスベクター技術を用いた新規結核ワクチンの共同開発を実施することについて基本的に合意しましたので、お知らせします。本基本合意に基づき、三者は、2013 年
12 月までに共同開発契約を締結する予定です。
クリエイトワクチンは、大日本住友製薬と日本ビーシージー製造が、新規結核ワクチンの事業化を進めるために、2013
年7 月31 日に設立した合弁会社です。
結核は 3 大感染症の一つであり、世界では 1 年間に新たな患者が約 860 万人発生し、約 130
万人が死亡しています。特にアジア、アフリカ諸国に多く蔓延しており、日本においても、毎年 2 万人以上が感染し、2
千人以上が死亡しています。既存のワクチンにおいては、乳幼児に対しては極めて高い効果が認められていますが、成人の肺結核に対する効果は乏しく、新規結核ワクチンの開発が望まれています。本剤は、基盤研の有する、ヒトパラインフルエンザ
2 型ウイルスベクター技術を臨床応用した粘膜ワクチンであり、開発に成功すれば本技術を用いた世界初の結核ワクチンとなります。
大日本住友製薬は、第三期中期経営計画で目標として掲げた新規事業分野のひとつとして、ワクチン事業への参入を計画しており、本事業の推進により将来の事業基盤の構築に寄与することを期待しています。日本ビーシージーは、BCG
ワクチンの、製造、販売、輸出を通じて、結核ワクチン事業に関する豊富な経験を有しています。
Aeras は、アカデミア、製薬企業、バイオベンチャーとのグローバルな提携を通じて、6
つの結核ワクチン候補品の開発に関与しており、前臨床、臨床開発、免疫学およびワクチン製造における専門知識・技術を提供しています。また、基盤研は、第 2
期中期計画において「次世代ワクチンの研究開発」を重点領域の一つとして位置付け、次世代ワクチンおよびその免疫反応増強剤(アジュバント)の開発ならびにそれらの投与法の研究開発を行っています。
基盤研、Aeras、クリエイトワクチンの三者は、本剤について共同で開発を進めることにより、結核の予防に大きく貢献できることを期待しています。
(ご参考)
【医薬基盤研究所について】
基盤研は、創薬の推進・支援に特化した日本で唯一の独立行政法人です。基盤研は「医薬品等の基盤的技術研究」、「難病・疾患資源研究」、「医薬品等の研究開発振興」という三つの事業を行い、民間企業、大学等における新たな医薬品・医療機器の開発を目指した研究を支援しています。
【Aeras について】
Aeras は、アフリカ、アジア、北米およびヨーロッパなど、世界中のパートナーと協力して結核ワクチンを開発する非営利団体です。Aeras
は強固な早期ステージの候補化合物ポートフォリオを持ち、6 つのワクチンの臨床試験を支援しています。
Aeras は、米国メリーランド州(ロックビル)、南アフリカ(ケープタウン)および中国(北京)に拠点を有しています。
【クリエイトワクチンについて】
クリエイトワクチンは、大日本住友製薬および日本ビーシージー製造が、基盤研および Aeras
と共に結核ワクチンの開発を行い、その商業化を進めるために設立した合弁会社です。
【大日本住友製薬について】
大日本住友製薬は、人々の健康で豊かな生活のために、研究開発を基盤とした新たな価値の創造により、広く社会に貢献することを企業理念としています。大日本住友製薬は、この理念を実現するため、また、日本はもちろん世界の方々に革新的で有用な医薬品をお届けするため、新薬の研究開発に全力を注いでいます。
【日本ビーシージーについて】
日本ビーシージーは、ワクチンの製造や研究を通じて得た、優れた知識、技術を活かし、高品質な製品を安定供給し、独創的な製品を開発することを通じて、世界の人々の健康に貢献します。
2013 年3 月28 日 大日本住友製薬
日本網膜研究所と大日本住友製薬の資本提携について
~iPS 細胞技術の実用化に関する連携に向けて~
日本網膜研究所と大日本住友製薬は、本日、大日本住友製薬が日本網膜研究所に出資し、日本網膜研究所との間でiPS
細胞技術の実用化に関する連携の協議を行うことについて、基本合意書に調印しましたので、お知らせします。
本合意に基づき、大日本住友製薬は、日本網膜研究所による15 億円の第三者割当増資を引き受けます。大日本住友製薬は、日本網膜研究所との間で網膜疾患を適応症としたiPS
細胞技術の実用化に関する国内外における連携に向けて、独占的に協議します。
大日本住友製薬は、2013
年度を起点とする第三期中期経営計画において、細胞医薬/再生医療の事業化に向けて取り組みを本格化することを掲げています。大日本住友製薬は、このたびの本合意が、将来の細胞医薬/再生医療領域での事業基盤の構築に寄与することを期待しています。
日本網膜研究所は、理化学研究所認定ベンチャーであり、独立行政法人理化学研究所が発明した日本発の技術に係る特許の実施許諾に基づいて、iPS
細胞から分化誘導した網膜色素上皮細胞移植による、加齢黄斑変性の新たな治療法を開発することを目指しています。さらにこの治療開発を端緒として、視細胞移植、網膜再生薬、検査法開発などにより、現代の難治性網膜疾患を治療可能な疾患にすることを目指しています。
両社は、難治性網膜疾患の患者さんに一刻も早く治療方法をご提供するために、また将来のiPS 細胞による再生医療の礎となるために、iPS
細胞の実用化に関する連携に向けて協議を進める所存です。
(ご参考)日本網膜研究所の概要
(1) 名称: 株式会社日本網膜研究所
(2) 所在地: 福岡市東区
(3) 代表取締役社長: 鍵本忠尚
(4) 設立年月: 2011 年2 月 24 日
(5) 株式の種類: 非上場
2013年9月4日 Healios(ヘリオス)に改称
Helios(ギリシャ神話の太陽の神)+Heal(癒す、治す)の二つの言葉から構成され、
難治性疾患治療の新たな希望の光と、疾患に侵された患者様を癒していきたいという願いが込められております。
---------------
2013年12月2日 大日本住友製薬
ヘリオスと大日本住友製薬の再生・細胞医薬事業に関する提携のお知らせ
~世界初のiPS細胞技術を用いた再生・細胞医薬事業に向けた共同開発~
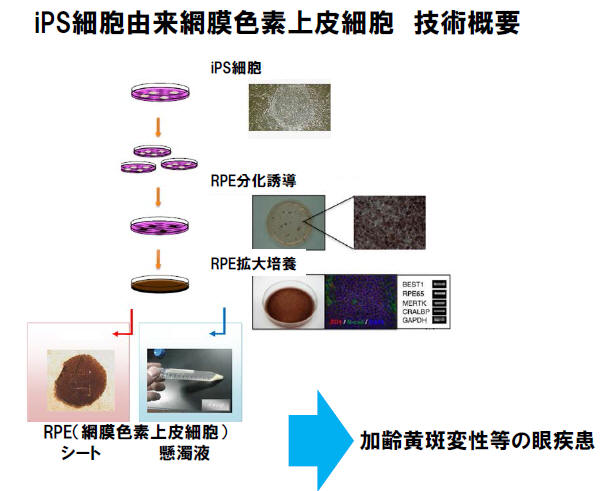
ヘリオス(Healios 旧:日本網膜研究所)と大日本住友製薬は、本日、加齢黄斑変性等の眼疾患を対象としたiPS細胞由来網膜色素上皮細胞(RPE細胞)を用いた国内における共同開発契約を締結しましたので、お知らせします。
網膜は、目の内側にある、光や色を感じる視細胞などの神経細胞が敷き詰められた薄い膜で、目をカメラに例えるとレンズを通った光が像を結ぶフィルムの役目になります。RPE細胞は、網膜の外側にある一層の細胞で、茶色の色素と多角形の形態により、他の細胞と容易に区別することができます。RPE細胞の主な機能としては、血液網膜バリア、貪食能、栄養因子の分泌、が挙げられます。貪食能は隣接する視細胞から出る老廃物を貪食し、メンテナンスを行う機能で、これがうまく働かないと視細胞が損なわれ、視力低下につながります。またRPE細胞には、PEDF
とVEGFという栄養因子を分泌して網膜を保護したり、外側から余計な血液成分などが入り込んでくるのを防ぐバリアとしての機能があります。
ヘリオスは、iPS細胞から、これら生体内のRPE細胞と同じ形態と機能を持つRPE細胞を分化誘導することに成功しています。
両社は、2013年3月28日に、大日本住友製薬がヘリオスに出資し、両社間でiPS細胞技術の製品化に関する連携に向けて協議を進めることについて、基本合意書を締結したことを発表しています。
本共同開発契約に基づき、両社は、iPS細胞由来RPE細胞を細胞医薬品として、国内での早期の使用を可能にすべく、早期の臨床試験着手および新薬事法下での加齢黄斑変性等の疾患を適応症とする製造販売承認取得を目指します。
本共同開発の方針、分担、意思決定等は両社で構成する共同開発委員会で決定します。大日本住友製薬が提供する最大52億円の開発費用を基に、国内におけるiPS細胞由来RPE細胞による細胞医薬品の開発を共同で行い、ヘリオスが製造販売承認の取得および販売を行うことに合意しています。
また、両社は、将来的に本共同開発によって製品化されるRPE細胞医薬品に関して、その製造や販売促進を両社で共同して行うため、本日、合弁契約を締結しました。本合弁契約に基づき、両社は、2014年2月を目途として、合弁会社を設立する予定です。
さらに、両社は、本日、ヘリオスが保有する眼疾患領域におけるiPS細胞由来RPE細胞の大量培養を始めとする各種技術・ノウハウに関する実施許諾契約を締結しました。大日本住友製薬は、本実施許諾契約の締結により、ヘリオスの保有する技術・ノウハウを取得し、再生医療/細胞医薬分野における取組みをさらに強化できると考えています。一方、ヘリオスは、本実施許諾契約に基づき、大日本住友製薬より契約一時金として5億円、開発時マイルストンとして最大11億円を受け取ります。
両社は、加齢黄斑変性を始めとする難治性網膜疾患を罹患する方々に一刻も早く治療法を提供するために、相互に協力してiPS細胞を用いた細胞医薬品の製品化に取組む所存です。
 |
|
加齢黄斑変性
網膜色素上皮(RPE)細胞の変性・萎縮・剥離
⇒網膜への栄養補給、老廃物消化、バリア機能低下
老廃物蓄積
脈絡膜新生血管発生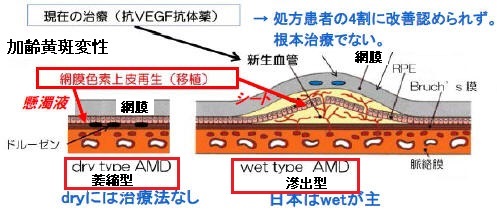
|
共同開発契約の対象:
(1) 製品 : iPS 細胞由来RPE 細胞
(2) 適応症 : 眼疾患(滲出型加齢黄斑変性:Wet AMDなど)
(3) 地域 : 日本
合弁会社の概要:
(1) 会社名 : 未定
(2) 所在地 : 未定
(3) 代表者 : 鍵本 忠尚
(4) 事業内容 :眼疾患領域における医薬品・医療機器及び再生医療等製品の製造販売等
*合弁会社は、共同開発で得られた成果を、ヘリオスおよび大日本住友製薬からライセンスを受けます。成果に伴う対価を合弁会社から両社へ均等に配分します。
(5) 資本金 : 5,000 万円
(6) 設立年月 : 2014 年2 月(予定)
(7) 株主構成 : ヘリオス 50%、大日本住友製薬 50%
ヘリオスの概要:
ヘリオスは、独立行政法人理化学研究所認定ベンチャーであり、理化学研究所が発明した日本発の技術に係る特許の実施許諾に基づいて、iPS 細胞から分化誘導したRPE
細胞移植による、加齢黄斑変性の新たな治療法を開発することを目指しています。さらにこの治療開発を端緒として、他領域のiPS
細胞を用いた治療方法開発、視細胞移植、網膜再生薬、検査法開発などにより、現代の難治性疾患を治療可能な疾患にすることを目指しています。
-----
ヘリオスは世界で初めて臨床研究計画が承認されたiPS細胞で失われた網膜の黄斑を再生する医療に用いる「網膜細胞シート」の作成を手がける。
理化学研究所(理研)と先端医療振興財団(神戸市中央区)は2013年7月30日、iPS細胞を使い、目の網膜を再生する世界初の臨床研究を8月1日に開始すると発表した。目の網膜に異常が出て失明の恐れもある「滲出型加齢黄斑変性」の患者6人を対象に計画。2月に厚生労働省に計画を申請、今月19日に了承された。
理研の高橋政代プロジェクトリーダーは「新しい治療をつくるための第一歩。これからが長い道のりで、慎重に進めないといけないし、責任をひしひしと感じる」と決意を述べた。
日本経済新聞 2015/6/14
そこが知りたい 後発薬台頭、製薬各社にどう影響
日本製薬工業協会会長(大日本住友製薬社長)多田正世
新薬出せねば行き詰まり
新薬に比べて割安な後発医薬品の普及が加速している。厚生労働省は医療費を抑制するため、2020年度までに医薬品に占める後発薬の数量シェアを現在の50%強から80%以上に高める方針を打ち出した。製薬企業の経営にどう影響するか。新薬メーカーが加盟する日本製薬工業協会の多田正世会長に話を聞いた。
ーー 後発薬の普及目標が引き上げられます。
「政府の使用促進策が効き、後発薬は急速に普及している。今の勢いが続くと、厚生労働省が打ち出した20年度、シェア80%との後発薬の新しい普及目標は達成できるのではないか」
「ただ後発薬が普及すると、新薬メーカーの収益を支える特許切れ新薬(長期収載品)の販売は減る。実際に製薬協に加盟する22社の国内医療用医薬品の総売上高は昨年度、4兆900億円と約4%減った。減収はデータを比較できる11年度以降で初めてだ」
ーー 新目標の達成時期を3年早め17年度にすべきだとの考えもあります。
「事業環境が2年で激変すれば、我々は手の打ちようがない。フェアではない。新薬開発は10~15年かかり、開発を急いでも間に合わない。売上高が減るなかで利益を確保するには、大幅なコスト削減を断行するしかない。5年あれば研究開発費や人件費などを計画的に減らせる。環境変化にある程度は対応できるだろう」
ーー 後発薬メーカーに比べて新薬メーカーは高コスト体質です。
「新薬を開発するための研究開発部門や、新薬発売後の副作用情報などを収集する専門組織を抱えているからだ。社長を務めている大日本住友製薬のの場合、連結売上高の2割強にあたる年間870億円を研究開発に投じている」
「副作用などの情報収集は新薬の特許が切れた後も続け、当社で100人強が従事している。新薬の供給責任を全うするため、薬価や処方数量が想定を大きく下回った場合でも、生産を簡単には中止できない」
ーー 新薬メーカーの経営はどう変わりますか。
「海外売上高の比率が低い中堅メーカーほど厳しくなるだろう。こうした企業では売上高や利益の4~7割を特許切れ新薬が稼ぐ。割安な後発薬に処方がシフトすると、中堅メーカーは研究開発費や人件費を減らし利益を確保するだろう」
「だが研究開発費が減ると、肝心の新薬開発にも支障が出てしまう。新薬を出せない製薬企業の経営は、やがて行き詰まる。今後は新薬メーカーから後発薬メーカーに転換し、生き残ろうとする製薬企業が出てくるかもしれない」
聞き手から一言 新薬メーカー 意義問われる
日本にとって社会保障費の膨張をどう抑えるかは喫緊の課題で、割安な後発薬の普及促進は政策の大きな柱となっている。後発薬に取って代わられそうな特許切れ新薬への依存度が高い製薬会社の経営にとっては大きな打撃だ。
だからこそ新薬メーカーには、今まで以上に画期的な新薬を開発することが求められる。現時点では治療法のない病気向けの薬やより副作用が少ない薬を世の中に出すことができるのか。研究開発費を捻出し続ける知恵に加えて、新薬メーカーとしての存在意義そのものが問われている。
2015/6/25 日本経済新聞
大日本住友製薬、血液がんワクチン開発 17年にも最終臨床試験
大日本住友製薬は急性白血病を引き起こす難病の血液がん「骨髄異形成症候群」に対するがんワクチンを開発した。今後2年間で健常者やがん患者ら40人程度に投与し安全性や有効性を調べる。2017年にも最終的な臨床試験を始める。大日本住友は副作用の少ないがんワクチンの開発を急ぎ、早期に国内外で販売したい考えだ。
がんワクチンは細胞に発生するたんぱく質の一種「ペプチド」を人工的に合成したもので、体内に打ち込み免疫細胞の働きを促す。大日本住友は治療が難しい血液がんのワクチンを世界で初めて実用化することを狙う。
開発するワクチンは免疫性能を高めて、がんの増殖を抑える働きを持つ。根治にはつながらないが、副作用が少なく幅広い患者で長期間の延命効果を期待できる。
骨髄異形成症候群は世界で30万人の患者がいるとされ、うち日本でも1万人程度を占める。治療には家族・親族らの骨髄を移植することが必要だが、免疫不全を引き起こすこともあり手術による治癒は簡単ではない。
大日本住友は精神疾患領域の治療薬が主力製品だ。最近では創薬ベンチャーのヘリオスと組み、iPS細胞を使った目の難病の治療薬の開発を始めている。がんワクチンで年間500億円以上の売上高を目指す。
世界の製薬業界ではがんの治療法としてワクチンなどの免疫療法が「第4の治療法」として注目を集めている。これまでは切除手術、放射線治療、抗がん剤投与の3つが中心だった。がんのワクチンは富士フイルムが前立腺がん、塩野義製薬が食道がんの治療用にそれぞれ開発に取り組んでいる。
2016/9/27 日本経済新聞
大日本住友、がん幹細胞治療の新薬
日米で来年度発売
大日本住友製薬は2017年度にがんの再発や転移の原因とされる「がん幹細胞」を治療する新薬を発売する。日本と米国で最終的な臨床試験(治験)で効果の確認を進めており、まず胃がん向けに製造販売の承認を取得する。「がんの親玉」であるがん幹細胞を攻撃する大型新薬となる見通しだ。
開発中の新薬は「ナパブカシン」。がん幹細胞は新たながん細胞を生み出したり、他の臓器・組織に転移したりする。従来の抗がん剤や放射線治療は通常のがん細胞を攻撃するが、がん幹細胞にはほとんど効果がない。
人の免疫機能を生かした小野薬品工業の新型治療薬「オプジーボ」は、がん幹細胞にも一部効果があるとみられる。ただ、製造には細胞の培養などが必要でコストが高かった。
大日本住友のナパブカシンは治験でがん幹細胞を狙い撃ちして攻撃し、患者の生存率を高める結果が出ている。がん患者には他の抗がん剤の併用で治療効果が高まることも確認。胃がんのほか、肺がんや大腸がんへの治験も進め、幅広い薬効で承認の取得を狙う。従来の医薬品と同様に化学合成で製造し、コストも抑えられるという。
大日本住友は12年に米バイオベンチャーのボストン・バイオメディカル(マサチューセッツ州)を約160億円で買収。ナパブカシンは同社が持っていた新薬候補だった。
大日本住友は主力の抗精神病薬「ラツーダ」の特許切れを19年に控える。ナパブカシンを新たな稼ぎ頭とし中長期的に安定した収益体質を築く。
---
ナパブカシンNapabucasin(BBI608)とAmcasertib(BBI503)
ナパブカシンおよびAmcasertibは、がん細胞に加え、がん幹細胞(幹細胞様性質を有するがん細胞)に対しても作用して、抗腫瘍効果を発現する新しいメカニズムの低分子経口剤です。
がん幹細胞は、がんの再発および転移あるいは治療抵抗性の原因になると考えられております。既存の抗がん剤は、がん細胞に対して細胞死を誘導または増殖抑制効果を示しますが、がん幹細胞には効果を示しません。
ナパブカシンおよびAmcasertibは、がん幹細胞およびがん細胞の両方に作用するために、がん治療の課題である治療抵抗性、再発あるいは転移に対する効果が期待されます。

日経産業新聞2017年11月21日
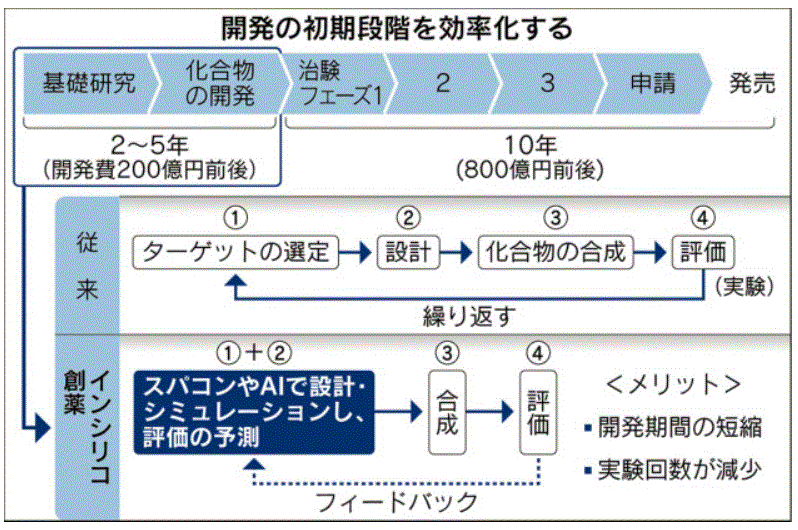
大日本住友製薬 精神疾患分野でインシリコ創薬
大日本住友製薬はコンピューターなどで新薬候補の化合物を効率良く絞るインシリコ創薬の手法で、屋台骨である精神・神経疾患の薬の開発を急いでいる。軸になるのはこの手法を活用している米国、スコットランドベンチャーとの協業。10の化合物を生みだし、うち2つは米国で臨床試験(治験)を進めている。
インシリコ(in silico)というのは「シリコンの中で」、すなわち「コンピュータを用いて」という意味
インシリコ創薬はスーパーコンピューターや人工知能を使い、病気の原因を阻害するような化合物を見つける技術。動物実験などを繰り返す一般の化合物探索と比べ、実験の回数や時間を減らせる。多くの製薬会社が利用し始めている。
大日本住友製薬が治験に入っている新薬候補は、幻覚や妄想が出る統合失調症と、うつとそうを繰り返す双極性障害を対象とした2つ。統合失調症の薬は米国で、2016年12月から国際共同治験を始めた。双極性障害も、米国で第1相治験に入っている。
米子会社のSunovion
Pharmaceuticalsがバイオベンチャー、米
PsychoGenics との共同開発でこの2種類の候補を生みだした。
PsychoGenicsは、マウスの不安やうつといった精神・神経に関する複雑な行動データを豊富に持っている。
さまざまな化合物を投与されたマウスが、実験用の迷路のなかで立ち止まる、震える、ほおをかくなどといった動作を高性能のカメラでとらえて、行動があらわす意味を特定する。これらの動作は、通常の観察では判別が難しい。
PsychoGenicsはマウスに与えた化合物とその結果出てくる行動についてのアルゴリズム(計算手法)を開発してきた。化合物のデータさえあれば、マウスへの効き目を予測できる。
薬の開発は、まず動物で効果を調べてからヒトの治験に入っていく。ただ、精神・神経疾患分野は、動物から人間と同じ類いのデータを集めることが難しく、人間の治験に進むまでに時間がかかる。大日本住友はサイコジェニクスの力を借りて、動物試験のハードルを低くした。
原田秀幸研究本部長は、インシリコ創薬の効果について「開発のコストとスピードを2~3割効率化できる」と語っている。
大日本住友はスコットランドのExscientia
とも、共同開発に取り組んでいる。化合物について、合成の手順とそれにかかる時間などのコンピューターシミュレーション技術を持つ。
一般に新薬候補の発見まで数年から10年かかるとされる。Exscientiaとの開発ではわずか1年で第1弾の候補を発見した。現在も精神・神経疾患分野でシミュレーションを続けている。
大日本住友は日本での開発でも、インシリコ創薬の手法を活用している。理化学研究所が保有している世界有数のスーパーコンピューター「京」を使い、神経伝達物質やホルモンの動きを調べ始めた。
同社はコンピューターを使った化合物の探索や結晶構造の分析を、国内製薬の中で先行して取り組んできた。
新しいアルゴリズムが出てきたり、コンピューターの性能が上がったりして、インシリコ創薬を以前よりも活用しやすくなっている。
インシリコ創薬の重要性が増している理由には開発コストの増加もある。医薬品の開発が成功する確率は3万分の1とも言われ、1つの新薬の発売までに数百億~1千億円近い投資が必要になる。開発費用が高ければ高いほど、製品価格も高くなる。
同社の精神・神経疾患分野の大型薬「ラツーダ」は世界での売上高が約1700億円にのぼり、会社全体の4割を占めている。協業によるインシリコ創薬の手法の導入は、強みを持つ分野をさらに効率化する取り組みとなる。
原田氏は製剤など汎用の技術は外注するとともに「研究現場では最先端の技術を活用していく」と語っており、iPS細胞の利用などと並んでスパコンやアルゴリズムの技術を積極的に創薬に取り入れていく考えを示している。
2018年4月25日 大日本住友製薬
マラリア治療薬候補化合物の同定に関するMMVとの共同研究契約締結のお知らせ
大日本住友製薬は、この度、Medicines for Malaria Venture(スイス・ジュネーブ、以下MMV)と
、マラリアの治療薬候補化合物の同定を目指した共同研究の実施に関する契約を締結しましたので、お知らせします。
本共同研究は、当社が、2015年からMMVと進めている「マラリアに対する化合物スクリーニングプログラム」が進展したものであり、本プログラムにより当社が所有する化合物ライブラリーから見出された化合物(ヒット化合物)をもとに、本共同研究において、マラリアの治療薬候補化合物(リード化合物)を同定します。
本共同研究および本プログラムは、いずれも公益社団法人グローバルヘルス技術振興基金(Global Health Innovative Technology
Fund)の助成案件に選定されています。
マラリアは、マラリア原虫を持つ蚊が媒介する寄生虫症であり、世界保健機関(WHO)によると、2016年にはアフリカ諸国を中心とした91の国と地域において、2億人以上が罹患・約45万人が死亡しており、その大部分は5歳以下の子供達と報告されています*。
*:http://www.who.int/mediacentre/factsheets/fs094/en/
既存の治療法に対する耐性マラリア原虫の出現が問題となっており、マラリア撲滅に向けて革新的な新薬が望まれています。当社とMMVは、本共同研究において、複数の
マラリア治療薬候補化合物について詳細な活性評価などを開始し、マラリアの新規治療薬へと繋がる特性をもつマラリア治療薬候補化合物を1年以内に特定することを目指します。
MMVは、マラリアにおける専門的知識および経験を生かして研究を推進し、当社は、専門性に基づく科学的見地から創薬戦略を立案するとともに、MMVに対して助言を行います。
当社は、国内外の人々に革新的で有用な医薬品を届けるため、新薬の研究開発に全力を注いでおり、MMVとの共同研究を通じて、アンメット・メディカル・ニーズの高いマラリアにおいて、当社の持つ革新的
な創薬技術の活用可能性を探り、医薬品アクセスの向上を目指します。
MMVは、抗マラリア薬の研究開発をリードするProduct Development Partnership(PDP)です。
その使命は、新しく、効果的で安価な価格の抗マラリア薬の発見・
開発・提供を通じて、マラリア流行国でその脅威にさらされている人々の治療および予防に貢献することであり、世界最大規模のポートフォリオを有しています。
2018/11/12 住友ベークライトと大日本住友製薬、体外診断用医薬品のJVを設立
住友ベークライトと大日本住友製薬は2018年11月12日、両社でJVを設立し、大日本住友製薬の100%子会社のDSファーマバイオメディカルの事業のうち、体外診断用医薬品事業(感染症、骨・カルシウム代謝、循環器疾患等)を承継することで基本合意したと発表した。
既に10月9日にJVのSBバイオサイエンス㈱を設立している。今後、DSファーマバイオメディカルのこの事業の権利義務を吸収分割で承継し、2019年4月1日から営業を開始する。
SBバイオサイエンスは住友ベークライトが60%、大日本住友製薬が40%出資し、社長は住友ベークライトから出す。この事業の2018年3月期の売上高は17億円。
住友ベークライトは、QOL領域を一つの柱として展開しており、一環として細胞培養器・糖鎖分析用試薬、マイクロフルイディスク(微細流路中に微量液体を流し、分離や反応を効率化する技術)部材を中心としたバイオ関連事業を推進している。
JVはDSファーマバイオメディカルの診断薬事業のノウハウに、住友ベークライトの技術を組み合わせ、新たな診断薬のR&Dを加速する。
ーーー
DSファーマバイオメディカルは、2001年4月に住友製薬バイオメディカルとして営業を開始し、2005年10月の大日本住友製薬発足に対応して2006年6月に現社名に改称した。
2007年4月に大日本住友製薬からラボラトリープロダクツ事業を包括的に承継し、現在では診断薬の開発・輸出入・販売、オーソライズド・ジェネリック(AG)の製造販売を行っている。
新しいJVに承継する体外診断用製品は下記の通り。
- 骨・カルシウム代謝関連製品
- 高感度迅速検査システム
- 迅速検査
- 呼吸器感染症
-
消化器感染症
-
性感染症
-
循環器疾患
- 血中薬物濃度測定 その他生化学的検査
ーーー
DSファーマバイオメディカルには、オーソライズド・ジェネリック(AG)事業が残る。
なお、同社は他に研究用資材事業として細胞・培地、試薬、各種研究用器具の販売を行っていたが、2018年6月に販売を停止し、製品は実験動物の飼育や受託試験、研究用の試薬の開発を行っている㈱ケー・エー・シーに移管している。
2019年10月7日
SBバイオサイエンス(住友ベークライトが60%、大日本住友製薬が40%)
『トリアージテスト』(体外診断用医薬品)の事業移管に関するお知らせ
米医薬品大手のAbbott
Laboratoriesは2017年4月14日、診断薬・機器の米Alere
Inc.を総額53億ドルで買収することで再合意したと発表した。
Alereはマラリアやデング熱など感染症の診断に強みを持つ
両社は2016年2月に総額58億ドルでの買収に合意したが、AbbottはAlereの会計処理などに懸念を示し、最大5000万ドルの違約金で買収合意の破棄を提案した。しかしAlereが拒否したため、合意破棄を求めて提訴していた。
両社は同日、訴訟の取り下げでも合意した。2017年10月3日に買収手続きを終えた。
2017年10月6日、Quidel社は、Alere
Inc.(現:Abbott
Laboratories)のトリアージ関連事業の取得完了
Quidel社は米国 San
Diegoに本社を置く臨床検査薬の製造メーカーで、現在では臨床検査薬だけではなく、設立以来30年にわたる臨床検査薬製造メーカーとしての経験を活かして独自に開発された試薬やキット類を研究市場向けに販売している。
日本においては、SBバイオサイエンスがQuidel社から事業移管を受けた。
SBバイオサイエンス(SBBS)は、本邦における『トリアージテスト』事業の販売契約をQuidel
Corporationと締結し、アボットダイアグノスティクスメディカル(旧アリーアメディカル)が製造販売する「トリアージテスト』事業を当社に移管致しますことお知らせいたします。
『トリアージテスト』は、専用機器である『トリアージテストメーター(一般医療機器特定保守管理医療機器)』とその専用試薬(体外診断用医薬品)からなる循環器救急に特化したPOCT(pointof
care testing)システムで、試薬には『トリアージテストCP』、『トリアージテストNT-proBNP』、『トリアージテストDダイマー』が販売されており、救急外来等、患者のベッドサイドで行う緊急検査に適しています。
トリアージ(Triage) テスト
メーターは、現在の米国の病院の約50%に使用され、世界50ヵ国以上で使用されている移動式免疫蛍光分析装置。心筋・胸痛のバイオマーカーであるトロポニンI、CK-MB、ミオグロビン、Dダイマー、NT-proBNPなどの検査項目を簡易に定量測定が可能。急性心筋梗塞、肺血栓塞栓症、心不全などの重大な疾病の診断補助や除外診断補助に使用。
今回の事業移管によりPOCT検査薬の製品ラインアップ、なかでも、循環器救急分野がより充実しました。
当社は今後も、POCT検査薬を通じて医療現場の緊急検査に貢献して参ります。
2017年10月6日、Quidel社は、Alere
Inc.(現:Abbott
Laboratories)のトリアージ関連事業の取得完了を発表しました。Quidel社とAbbott社は、これに伴う顧客への影響を最小限に抑えることで同意し、代替供給の手配が完了するまでは、トリアージ関連製品の販売をAbbott社が継続することが含まれていました。
日本においては、Quidel社とSBBSが、既存のパートナーシップを拡大し、トリアージ関連製品を扱うことで合意しました。
2019/9/4 日本経済新聞
大日本住友製薬 迫る「特許の壁」 大型薬、猶予は3年半 新薬候補の治験、相次ぎ失敗
大日本住友製薬が売上高の4割を占める大型の抗精神病薬「ラツーダ」で、「パテント・クレフ (特許の崖)」に迫られている。米国での特許訴訟により「ラツーダ」の後発薬が2023年2月まで発売されないようにしたものの、ここにきて期待していた新薬候補の治験に相次ぎ失敗した。
成長のバトンをつなぐ大型薬を出せるかどうか、残る猶予は3年半だ。
膵臓がんを対象にして日米などで臨床試験(治験)を進めていた抗がん剤の侯補「ナパブカシン」をめぐって7月2日、同社が組織した第三者委員会から開発中止を勧告されたと発表した。取引時間中の株価は一時5%安まで下げた。
ナパバブカシンはがんの治療だけでなく、転移や再発を抑制する効果も期待されていた。年間1000億円規模を売り上げる大型薬「ブロックバスター」の侯補で、21年度の日米発売をめざしている。なお望みをつなぐ結腸直腸がんを対象にした治験が成功すれば23年3月期に400億~500億円規模になるとみられるが、ショックは大きい。野村博社長は「中止勧告は意外。(効果が)ポジティブな患者もいた」と唇をかんだ。
ラツーダは2020年3月期に北米で約1900億円を売り上げる見通しのブロックバスターだ。「19年1月に特許が切れる」と主張する米国の後発薬メーカーとの訴訟で昨年11月に和解。23年2月まで後発薬を出せなくした経緯がある。
2019/1/25 大日本住友製薬、主力薬「ラツーダ」の特許で
後発薬各社と和解
ラツーダの「延長戦」に入ってからの治験の失敗はナパブカシンが初めてではない。1月下旬にはバイオベンチャーのサンバイオと組んで開発していた新薬候補「SB623」で、慢性脳梗塞での治験が失敗したと発表。翌日の株価は19%も下げた。ナパブカシン、SB623ともに治験を完全に断念したわけではないが、株式市場の期待は一気にしぼんだ。
日に日に近づいてくる特許の崖は険しい。市場予測の平均(QUICKコンセンサス)をみると、ラツーダの支えがある23年3月期までの連結純利益は500億円超だが、後発薬が出てくる24年3月期は92億円にとどまっている。
もっとも、製薬ビジネスには「一発逆転」がある。大日本住友には期待の新薬候補がまだ残っている。一つは「ポスト・ラツーダ」との呼び声がある統合失調症薬候補「SEP-363856」だ。詳細は明かしていないが、従来薬に比べて副作用が大きく抑えられ、治療できる症状の範囲も広いという.
米国では第2段階の治験結果がよく、審査手続きなどが簡略化される「画期的治療薬(ブレークスルー・セラピー)」に指定され、「大きなポテンシャルを秘めている」(大和証券の橋口和明氏)。第3段階の治験を経て23年度の実用化をめざしており、ぎりぎりのタイミングでラツーダからバトンをつなげるかもしれない。
もう一つはiPS細胞による再生医療の分野だ。大学など研究機関と連携し、細胞を大量培養できる工場を持っているのは世界で同社だけだ。
30年に2000億円規模のビジネスに育てる構想を掲げており、「他社に先駆けて投資を重ねており、うまくいけば先行者利益がある」(シティグループ証券の山口秀丸氏)との評価がある。
さらに、野村社長は「新薬侯補の取得に最大6000億円を投じる」と話す。製薬会社そのものではなく、有望な新薬侯補の特許技術などに照準を合わせているようだ。それでも、残り3年半の延長戦で勝機を見いだすのは容易ではない。株価は3日も前日比4%下げて年初来安値を更新した。年明けからの下落率は50%を超えた。
2020年10月08日 住友化学 / 大日本住友製薬
再生・細胞医薬分野のCDMO事業に関する合弁会社の設立および事業開始のお知らせ
住友化学と大日本住友製薬は、2020年9月、再生・細胞医薬分野の製法開発、製造などの受託(Contract Development and
Manufacturing Organization、「CDMO」)事業を行うため、合弁会社S-RACMO株式会社を設立し、このほど業務を開始しましたので、お知らせいたします。
再生・細胞医薬分野では、アカデミアやスタートアップ企業などでの生産体制の構築が開発・商業化上の課題となっています。住友化学と大日本住友製薬は、再生・細胞医薬の早期普及および産業化に貢献すべく、CDMO事業に進出することとしました。住友化学が有するiPS/ES細胞の基盤技術や医薬品の受託製造に関するノウハウと、大日本住友製薬が再生・細胞医薬事業における複数のプロジェクトで培った高度な製法開発や製剤開発などのノウハウを生かす考えです。
再生・細胞医薬分野のCDMO事業の市場規模は、2030年までに世界で約1.2兆円に拡大すると予想※されています。住友化学と大日本住友製薬は、グループシナジーを発揮して、本市場でのシェア獲得、CDMOに関わる技術・ノウハウの蓄積および高度化に取り組みます。また、CDMO事業への進出を通じて、住友化学においては低分子や核酸に次ぐ医薬品製造受託事業の拡充によるライフサイエンス領域の事業拡大を、大日本住友製薬は再生・細胞医薬分野における事業の多様化、収益貢献および新たな提携機会の獲得も目指します。
S-RACMOは、大日本住友製薬が所有する再生・細胞医薬製造施設「SMaRT」の一部、および大日本住友製薬の総合研究所(大阪府吹田市)内に今後新設される再生・細胞医薬製造施設を使用してCDMO事業を実施する計画です。また大日本住友製薬は、S-RACMOによる製造を視野に入れ、CorneaGen
Inc.(本社:米国ワシントン州)から日本における角膜内皮細胞(予定適応症:角膜疾患)の製造および製法開発を受託すべく、既に同社と交渉を開始しています。
※デロイトトーマツコンサルティング合同会社調べ
合弁会社の概要
|
会社名 |
S-RACMO株式会社
「S-RACMO」は、「Sumitomo」と「Regenerative
And
Cellular
Medicine
Organization」を組み合わせた造語です |
|
所在地 |
大阪府吹田市江の木町33-94(大日本住友製薬の総合研究所内) |
|
代表取締役社長 |
土田 敦之(前 大日本住友製薬 リサーチディビジョン研究企画推進部長) |
|
事業内容 |
再生・細胞医薬分野の製法開発、製造などの受託 |
|
資本金 |
5,000万円 |
|
設立年月日 |
2020年9月1日 |
|
株主構成 |
大日本住友製薬 51%、住友化学 49% |
付記 S-RACMO 株式会社への出資比率を 2024 年10 月1 日付で変更し、住友化学が
49%から 66.6%に持分比率を高め、事業運営を主導することに合意しましたので、お知らせいたします。
ーーーーーーーーーーーーーーーーー
2021年4月27日
S-RACMO株式会社
角膜内皮細胞の製造および製法開発の受託について
S-RACMOは、このほど、CorneaGen
Inc.(本社:米国ワシントン州)およびその子会社である合同会社コーニアジェン・ジャパンから日本における角膜内皮細胞(予定適応症:角膜疾患)の製造および製法開発を受託する契約を締結しましたので、お知らせいたします。
S-RACMOは、今後、大日本住友製薬が所有する再生・細胞医薬製造施設「SMaRT」の一部、および大日本住友製薬の総合研究所(大阪府吹田市)内に現在建設中の再生・細胞医薬製造施設を使用して、本件を含む
CDMO事業を実施する計画です。
【ご参考】
CorneaGen Inc.について
CorneaGen Inc.は、米国ワシントン州シアトルに本社を置き、世界 40 カ国以上に角膜移植のための角膜の提供や、眼科用の医療デバイスを販売するなど角膜疾患による失明の撲滅のために眼科医とその患者のサポートに取り組む企業です。
同社は、京都府立医科大学 特任講座
感覚器未来医療学 木下茂教授などから角膜内皮細胞の再生医療製品の基本技術に関わるライセンスを取得しています。
2021年9月30日
大日本住友製薬 /
大塚製薬
精神神経領域で開発中の4つの新薬候補化合物について
全世界を対象とした開発および販売提携のお知らせ
大日本住友製薬およびその米国子会社であるサノビオン・ファーマシューティカルズ・インクならびに大塚製薬は、本日(9
月30 日)、大日本住友製薬とサノビオン社が精神神経領域で開発中の以下の4つの新薬候補化合物について、全世界を対象とした共同開発および販売に関するライセンス契約を締結しましたので、お知らせします。
2009/9 大日本住友製薬、米国医薬品会社Sepracor
Inc.買収
2010/10 Sepracor Inc. をSunovion
Pharmaceuticals Inc.に改称
中枢神経系や呼吸器疾患、その他の疾患の患者を救うため、先進的な治療薬の創出、開発および販売に尽力している研究開発型の製薬企業。
米国を拠点にするセプラコール・インクと大日本住友製薬アメリカ・インクの合併に伴って設立された。
サノビオン・ファーマシューティカルズ・インクの社名の由来は、太陽(Sun)の力強さ、革新(Innovation)を組み合わせたもの
開発コード(一般名)
予定適応症 (現在の開発段階、地域)
SEP-363856(ulotaront) 統合失調症 (フェーズ3 米国、フェーズ2/3 日本・中国)
SEP-4199
双極I型障害うつ (フェーズ3 米国、フェーズ3準備中 日本)
SEP-378614 未定 (フェーズ1
米国)
SEP-380135
未定 (フェーズ1 米国)
本契約に基づき、サノビオン社は大塚製薬に対し、4 化合物の全世界における開発および販売を共同で行う権利を許諾し、大日本住友製薬グループ(大日本住友製薬、サノビオン社、住友制葯(蘇州)有限公司およびスミトモ・ファーマシューティカルズ・アジア・パシフィック・プライベート・リミテッド)は、大塚製薬と共同で4化合物の開発を行います。
販売については、米国、カナダ、日本、アジア(中国、台湾、シンガポール、タイ、ベトナム、マレーシア)においては大日本住友製薬グループが売上を計上し、国・地域ごとに大日本住友製薬グループと大塚製薬が原則共同プロモーションを行う予定です。欧州を含む
41 の国・地域では大塚製薬が売上を計上します(その他の地域については今後検討する予定)。
本契約下で実施されるすべての臨床試験、各国・地域における承認申請や販売に関する費用および利益については、サノビオン社と大塚製薬で折半します。なお、ulotarontの追加適応症、SEP-378614およびSEP-380135の適応症については、今後大日本住友製薬グループと大塚製薬で協議の上、決定します。
本契約の締結により、大塚製薬はサノビオン社に対し契約一時金として 270 百万米ドル(約 300
億円)を支払うほか、4
化合物の開発マイルストンとして 620 百万米ドル(約 690 億円、追加適応症の数によっては上回る可能性あり)および販売マイルストンを支払う可能性があります。
大日本住友製薬は2022年3月期に300億円を利益計上
大日本住友製薬の代表取締役社長である野村 博は次のように述べています。「このたび、グローバルに精神神経領域において事業展開する大塚製薬と契約を締結できたことをうれしく思います。4
つの化合物は大日本住友製薬が成長を期待する品目であり、両者で協力して価値のある薬剤をより早く確実に開発・提供し、世界のより多くの患者さんの治療に貢献できるように取り組みます。当社は、非定型抗精神病薬『ラツーダ』の米国での独占販売期間終了や将来の環境変化を見据えた取り組みとして、グローバル規模でのパートナリングによる持続的な成長を目指しており、今回の提携はその大きな一歩です」
大塚製薬の代表取締役社長である井上 眞は次のように述べています。「大塚製薬は、2002年の米国での抗精神病薬の発売からはじまり、現在に至るまで長期にわたり、自社の強みとパートナーシップの機会を活かしながら精神神経領域で世界の患者さんに貢献できる新しい治療を提供してきました。現在はアルツハイマー型認知症による行動障害の治療薬の開発や世界初のデジタルメディスンの展開など新たな分野での取り組みも進めています。本契約により、長年にわたり培ってきた経験やネットワークを活かし、両者で患者さんにとってのさらなる価値を届けることができることと期待しています」
大日本住友製薬は、2022年3月期第2四半期連結業績において、契約一時金を売上収益として計上する予定であり、2022年3月期業績予想に織り込み済みです。
(ご参考)
ulotaront(SEP-363856)について
本剤は、サノビオン社と PsychoGenics 社が共同で創製したセロトニン 5-HT1A アゴニスト活性を持つTAAR1(微量アミン関連受容体
1)アゴニストであり、ドパミン D2またはセロトニン 5-HT2A受容体には結合しない低分子経口剤です。サノビオン社は、in
vivo表現型SmartCube®プラットフォームと関連する人工知能アルゴリズムを使用してPsychoGenics社と共同で本剤を見出しました。
統合失調症患者を対象としたフェーズ 2 試験の結果では、統合失調症の陽性症状および陰性症状への効果を示し、錐体外路症状、体重増加、脂質およびグルコースの異常、プロラクチン上昇の副作用はプラセ
ボと同程度でした。本試験結果は、2020年4月にNew England Journal of Medicineに掲載されました。
本剤は、統合失調症を対象として、米国においてはフェーズ3試験を、日本および中国においては国際共同フェーズ
2/3 試験を実施中であり、その他の適応症についても検討中です。米国食品医薬品局(FDA)は、2019年5月に本剤を統合失調症の治療のためのBreakthrough
Therapyに指定しました。
SEP-4199について
本剤は、サノビオン社が創製したアミスルプリド鏡像異性体の非ラセミ混合物である低分子経口剤です。
サノビオン社は、アミスルプリドの薬理作用は鏡像異性体に特異的であり、S 体に対する R 体の比率を増加させることにより、ドパミンD2受容体に比べてセロトニン5-HT7受容体への作用が高まることを見出しました。
本剤は、抗うつ作用を強めるためにセロトニン 5-HT7 活性を高め、双極性障害うつ治療に適したレベルのドパミンD2受容体占有率となるようR体とS体の比率が85:15に設計されています。
サノビオン社は、2021年9月に米国において、双極I型障害うつを対象とした本剤のランダム化、二重盲検、プラセボ対照、並行群間、固定用量、国際共同フェーズ3試験を開始しました。日本も当該国際共同フェーズ3試験に参加します。
SEP-378614について
本剤は、サノビオン社と PsychoGenics 社が共同で創製した中枢神経系に作用する低分子経口剤です。
サノビオン社は、in vivo 表現型 SmartCube®プラットフォームと関連する人工知能アルゴリズムを使用してPsychoGenics
社と共同で SEP-378614 を見出しました。非臨床試験において、即効性かつ持続性の抗うつ薬様活性を発現し、神経可塑性を高める可能性が示唆されています。
本剤は、米国においてフェーズ1試験を実施中です。
SEP-380135について
本剤は、サノビオン社と PsychoGenics 社が共同で創製した中枢神経系に作用する低分子経口剤です。
サノビオン社は、in vivo 表現型 SmartCube®プラットフォームと関連する人工知能アルゴリズムを使用してPsychoGenics
社と共同で SEP-380135 を見出しました。非臨床試験において、焦燥、攻撃性、精神運動多亢進、うつ、社会的相互作用の欠如などの認知症に伴う行動・心理症状に対して有効性を示すことが示唆されています。
本剤は、米国においてフェーズ1試験を実施中です。
精神神経疾患について
精神神経疾患は、最も複雑で治療が困難な疾患の一つです。脳の疾患は、多くの場合、患者さんに障害をもたらし、患者さんのご家族や社会にも大きな影響を及ぼします。世界で約
6人に 1人が神経疾患を患っており
1、また、約2,900万人が双極性障害 2に、約2,000万人が統合失調症 3に罹患しているといわれています。
2022
年2月1日
大日本住友製薬の子会社
S-RACMO、再生・細胞医薬製造施設稼働
S-RACMO(本社:大阪府吹田市)は、吹田市の大日本住友製薬の敷地内に建設を進めていた、再生・細胞医薬製造施設(通称「FORCE」:Facility
of Regenerative and Cellular Medicine Organization)が完成し、2022
年2月より稼働しましたので、お知らせいたします。
再生・細胞医薬分野では、生産体制の構築が開発・商業化上の課題となっています。当社は、再生・細胞医薬の早期普及および商業化に貢献すべく、製法開発、製造などの受託(Contract
Development and Manufacturing Organization)事業に取り組んでいます。現在、大日本住友製薬が所有する再生・細胞医薬製造施設「SMaRT」の一部を使用し製造を実施していますが、今般、新たに本施設が稼働したことにより、新しい治療領域で成長著しい再生・細胞医薬品を開発する国内外のニーズに応えていきます。
本施設は、大日本住友製薬が
SMaRT
の運用等により培った製造ノウハウを活かした設計・仕様となっており、大阪空港等へのアクセスも良いことから、製造した再生・細胞医薬品を速やかに全国の主要地域へ輸送することが可能です。当社は、本施設を使用して、GCTP*1、cGMP*2など最新の基準に準拠した高品質の再生・細胞医薬品の製造受託を行うことにより、顧客の再生・細胞医薬品の開発・商業化に貢献してまいります。
*1:GCTP(Good
Gene, Cellular, and Tissue-based Products Manufacturing Practice):再生医療等製品の製造管理及び品質管理の基準
*2:cGMP(current
Good Manufacturing Practice):医薬品及び医薬部外品の製造管理及び品質管理の基準(米国)
【ご参考】
施設の概要
【名称】
再生・細胞医薬製造施設(通称
FORCE)
【所在地】
大阪府吹田市江の木町
33-94(大日本住友製薬・総合研究所内)
【事業内容】
再生・細胞医薬分野の製法開発、製造などの受託
【施工面積】
1028.4
㎡
【竣工】
2021
年
12
月(稼働
2022
年
2
月)
【仕様】・単独空調を装備した複数スイートを確保
・BSL2
対応
※
製法検討用ラボは別建屋に完備
2022
年
12
月
26
日 住友ファーマ株式会社
連結子会社住友ファーマアニマルヘルスの株式譲渡に関するお知らせ
住友ファーマは、本日(12
月
26
日)、当社の完全子会社である住友ファーマアニマルヘルスの全株式を、三井物産に譲渡することを内容とする株式譲渡契約を締結しましたので、下記のとおりお知らせします。
なお、本株式譲渡の実行は、独占禁止法に基づく規制当局の承認その他クロージング条件の充足を条件としています。
1.本株式譲渡の理由および目的
当社は、新たな中期経営計画策定に向け、事業基盤の強化のために事業の選択と集中を進める方針を掲げ、様々な施策を検討しています。その一環として、このたび、非医療用医薬品事業子会社である住友ファーマアニマルヘルスの全株式を三井物産へ譲渡することとしました。
住友ファーマアニマルヘルスは、1950
年の事業開始以来、コンパニオンアニマル事業、畜水産事業等の多岐にわたる事業展開を通じて、動物たちの健康を支える総合的なソリューション提供会社へと進化してきました。一方、三井物産は、アニマルヘルス事業を注力領域の一つとし、世界のアニマルヘルス産業の発展に貢献しています。三井物産の保有する国内外における広範な事業資産やビジネスネットワーク等を活用することで、三井物産と住友ファーマアニマルヘルスのシナジーが期待できることから、当社は、本株式譲渡が住友ファーマアニマルヘルスのさらなる成長につながると判断しました。
当社は、本株式譲渡により得られる対価を当社の事業基盤強化および成長エンジンの確立のための施策に活用するとともに、医療用医薬品事業に経営資源を集中し、当社の持続的な成長につなげることを目指します。
2.譲渡方法・譲渡価額
2024
年
3
月期第
1
四半期中を目途に、当社が保有する住友ファーマアニマルヘルスの全株式を三井物産へ譲渡します。本株式譲渡の完了により、住友ファーマアニマルヘルスは当社連結子会社から、同社の完全子会社であるマルピー・ライフテック株式会社は当社子会社から除外されます。
譲渡価額については、譲渡先からの要請により非開示としています。
※
適用される規制当局への届出その他必要な承認等により変更される可能性があります。
