2009/10/17 日本経済新聞夕刊
2010/5/27 日本経済新聞
2010/5/28 日医工
サノフィ・アベンティスグループとの戦略的提携に伴う第三者割当により発行される株式の募集に関するお知らせ
当社は、平成22年5月28日開催の取締役会において、サノフィ・アベンティスグループとの日本におけるジェネリック医薬品事業の戦略的提携等にかかる決議を行い、その一環として、以下のとおり、第三者割当により発行される株式の募集を行うことを決議しましたので、お知らせいたします。
1.募集の概要 特定の医薬品を独占的に販売するための事業提携 、並びに、当社及びサノフィ・アベンティス株式会社による日本国内において ジェネリック医薬品事業を展開する共同出資会社「日医工サノフィ・アベンティス株式会社」の設立 等に関する合弁契約書を締結し、戦略的提携関係を結ぶことといたしました。また、当該戦略的提携関係をより強固なものとするために、当社とサノフィ・アベンティス及びサノフィ・アベンティス株式会社との間で株式引受契約書を締結し、当社は、サノフィ・アベンティス株式会社に対して当社の株式(普通株式)1,524,500
株(本件新株発行募集前の 発行済株式総数の4.89% )の割当てを行い、一方、サノフィ・アベンティス株式会社が当該株式を引き受け、当社に対して 4,411,903,000 円の支払い を行うことを合意しました。
商号
日医工サノフィ・アベンティス株式会社
3.調達する資金の額、使途及び支出予定時期
Sanofi-aventis and
Generics Leader Nichi-Iko to Establish New Joint Venture for
Generics in Japan
Sanofi-aventis and
Nichi-Iko Pharmaceutical Co., Ltd. (Nichi-Iko) announced today
that they have signed an agreement to establish a new joint
venture, called sanofi-aventis Nichi-Iko K.K., in order to
develop a generic business in Japan. “ We
are extremely pleased to establish this joint venture with
Nichi-Iko, that will allow us to strengthen our leadership and
develop a strong presence in the fast-growing generic market in
Japan, ” said Olivier Charmeil, Senior Vice
President, Asia Pacific & Japan, sanofi-aventis. “ Our objective is to provide the
Japanese generic market, which is expected to further expand in
the future, with high quality and affordable pharmaceuticals,
supporting the government's stated objective of increasing
generic penetration. This strategic agreement between Nichi-Iko
and sanofi-aventis will leverage both companies' respective
strengths to meet the needs of medical institutions and patients. ” We are equally
gratified to form this long-term partnership which will enable us
to combine Nichi-Iko ’ s expertise in generic business in
Japan and sanofi-aventis ’ resources, ”
said Yuiichi
Tamura, Nichi-Iko President and Chief Executive Officer. “ This announcement will deliver a
strong message of a new strategic alliance in the market, showing
clearly our willingness to further expand the generic market in
Japan. ” As a first step,
the joint venture will take over the marketing and distribution
rights in Japan for the antiinsomnia agent AmobanTM (zopiclone)
from sanofi-aventis K.K. AmobanTM sales reached 5.1 billion Yen
or 43 million Euros* in 2009. Nichi-Iko will ensure the promotion
and distribution of AmobanTM through its large network of
pharmacies, wholesalers and medical institutions. ’ s expertise in manufacturing,
development, and distribution of generics in Japan and
sanofi-aventis ’ resources and global portfolio of
generics.
About the generics market
in Japan ’ s second largest pharmaceutical
market, with annual sales of approximately 8.85 trillion JPY
(based on NHI price) - around 74 Billion Euros*. Around 8 % of
its prescription drug sales (20 % in sales volume) are generics.
By 2012, a combination of major drug patent expiries, a rapidly
aging demographic, and wide ranging government initiatives to
reduce health care spending are making the generic drug sector in
Japan increasingly attractive. The Japanese government is
promoting the use of generics with the objective to reach more
than 30% of the total pharmaceutical market in volume by 2012.
平成24年12月25日 味の素株式会社
味の素の100%出資の子会社である味の素製薬は、輸液・透析事業のさらなる発展と当該領域における治療への一層の貢献を目指して、味の素製薬㈱から輸液・透析事業を分割し、株式会社陽進堂(富山県富山市)と合弁会社を設立することに合意、本日、契約を締結しましたのでお知らせします。
1.合弁会社設立の背景及び目的
2013年10月4日 テルモ
テルモ、米国の先端医療機器ベンチャーファンドに出資
テルモは、米国のベンチャーキャピタルファンドであるEmergent Medical
Partners II L.P.(EMP-II)に同ファンドにおける最大出資となる上限25百万ドルまでの出資を決定しました。
欧米の大手医療機器メーカーでも、このようなベンチャーファンドへの出資を通した新技術の獲得は開発戦略の柱のひとつとなっており、当社もEMP-IIへの出資により、米国のベンチャーコミュニティに集まる最新の技術的知見を獲得できると期待しています。また、EMP-IIのオフィスにインターンを派遣することにより、「目利き」能力の向上も期待できると見込んでいます。
2014/6/12
明治HD、インドの製薬会社Medreichを買収
明治ホールディングスは 2009年4月1日に、同根企業である明治製菓と明治乳業が設立した共同持株会社で、両社は完全子会社に。
2011年4月に、明治グループ内事業再編により、
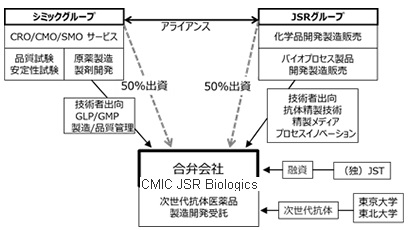
シミックとJSR、次世代抗体開発の合弁会社を設立
シミックホールディングスとJSRは、シミックが100%子会社として3月4日に設立した「シミックバイオロジックス株式会社」にJSRが50%の出資を行い、合弁会社「シミックJSRバイオロジックス株式会社」を設立することで合意しました。多重特異性抗体 *が注目されており、世界中で研究開発がすすめられていますが、その設計及び製造プロセスは確立されておりません。
多重特異性抗体とは複数の抗原に結合する特殊な抗体 のことで、その抗体一分子の中に異種の抗原結合部位を持つ。次世代の治療医薬、免疫診断薬への応用が期待されている。多重特異性抗体は化学合成または細胞融合で作製されるが、低収量・品質制御の困難さなど、商用利用には依然課題が多い。
このような背景の中、設立する合弁会社は、東京大学、東北大学が保有する3種類の異なる次世代多重特異性抗体シーズを用いた次世代多重特異性抗体の設計および製造プロセス、ならびにその工程管理、品質管理手法の開発 に取り組みます。事業スキーム
NexTEP:産学共同実用化開発事業 東京大学 大学院工学系研究科教授 津本 浩平
シミック JSRバイオロジックス株式会社の概要
合弁会社名: シミックJSRバイオロジックス株式会社 (英語名称:CMIC
JSR Biologics Co., Ltd.)
代表者: 代表取締役社長 小作 寛
本社所在地: 東京都品川区西五反田7-10-4
金剛ビル
出資年月日: 2014年7月1日
資本金: 10百万円
http://www.cmic-holdings.co.jp/
2014年9月2日 オムロン ヘルスケア
ブラジルでの、ネブライザの生産/販売会社「NS」社買収について ( nebulizer:喘息用吸入器)
オムロンヘルスケアは、ブラジルでのネブライザ事業の拡大施策として、ブラジル市場でシェアNo.1のネブライザ生産・販売会社である NS
Industria de Aparelhos Medicos
Ltda.の株式を100%取得いたします。9月1日に契約合意し、10月1日にすべの手続きを完了予定です。
近年、新興国の経済成長に伴う生活水準の向上や食生活の欧米化といった生活習慣の変化に伴い、生活習慣病患者の増加が社会的課題となっています。さらに、大気汚染による喘息、喫煙によるCOPD(慢性閉塞性肺疾患)などの呼吸器系疾患の患者も増加しています。
当社では、新興国での生活習慣病の予防・改善、呼吸器疾患の吸入治療分野における成長を事業戦略にかかげ、中国、インド、中南米などでの事業拡大に取り組んでいます。
ブラジルも、注力国の1つとしてとらえ、2008年に営業拠点を設立。血圧計を中心に、事業を展開してきました。近年のブラジルの経済成長は著しく、国民所得も、家庭用の医療機器市場が広がる目安である1万ドルを越え、今後市場のさらなる拡大が見込めます。さらに、ブラジルでは、ネブライザが医療機関のみならず家庭にも浸透しており、グローバルのネブライザ市場の約17%を占める世界最大市場となっています。
しかし、複雑な輸入手続きや高い輸入税率など、従来の輸入事業では解決が難しいブラジル固有の障壁があり、さらなる事業拡大には、ブラジル国内での生産体制の確立が必要であると考え、ブラジル企業との協業を探索してきました。そして、このたびブラジルにおいて、開発、生産、マーケティング、販売、アフターサービス網を有し、ブラジルネブライザ市場で約40%のトップシェアを持つNS社を買収するにいたりました。
これにより、輸入税のかからない現地生産による収益改善、在庫削減によるキャッシュフロー改善をはかるとともに、NS社の販売網を活用して、現在のブラジル市場での両社のネブライザシェア48%(オムロン8%、NS社40%)を、2017年度には55%以上に拡大し、ブラジルでの売上高を13年度の17.6億円から、2017年度には100億円以上を目指します。
NS社の概要
社名 NS
Industria de Aparelhos Medicos Ltda.
設立
1969年11月27日
事業内容
ネブライザの生産/販売
13年度連結売上 R$
97milion(45億円) 1R$=45円換算
従業員数
480名
資本金
21億円
所在地
サンパウロ市
2015/2/9 JSR 2021年3月、全発行済株式の取得を完了
医学生物学研究所の公開買付けの開始
JSRは、2月9日開催の取締役会において、以下のとおり、医学生物学研究所の普通株式を公開買付けにより取得することを決議いたしましたので、お知らせいたします。
本公開買付けは、連結子会社化することを目的とするものであること、及び本公開買付け成立後も引き続き上場を維持する方針であることから、買付け後の出資比率を51.00%とする。
Medical &
Biological Laboratories
1969年8月 名古屋市千種区に資本金85万円で株式会社医学生物学研究所(MBL)設立我が国初の抗血清メーカーを目指す
初の抗血清の開発・生産メーカーとして設立され、臨床検査薬や基礎研究用試薬の研究開発を行っている。
臨床検査薬の分野では自己免疫疾患検査薬で国内シェア80%以上を誇る。
基礎研究用試薬の分野では、細胞融合技術や遺伝子組換え技術を利用した製品開発を行い、ゲノム解析を採り入れた癌マーカー・抗体医薬の研究開発に力を入れている。
バイオベンチャー企業への投資も手がける。
2013年3月 JSRとの資本業務提携契約の締結及び第三者割当増資による新株式発行
ーーー
2013/3/12
医学生物学研究所との資本業務提携契約の締結及び第三者割当増資の引受けに関するお知らせ
当社は、平成25 年3 月12 日開催の取締役会において、株式会社医学生物学研究所(「MBL」)との間で資本業務提携を行い、MBL
の実施する第三者割当増資を引き受けることを決議し、同日付でMBL との間で資本業務提携契約を締結いたしましたので、下記のとおりお知らせいたします。
異動前 0%
2015年2月24日 ImaginAb,Inc. / JFEエンジニアリング
放射性バイオ診断薬の製造販売について協業検討
米国ImaginAb,Inc.とJFEエンジニアリングは、このたび、日本におけるPET診断用放射性医薬品の製造および販売に関する協業の検討に関する覚書を締結しましたので、お知らせします。
イマジナブ社は、微細な病巣にまで選択して結合する低分子化抗体を用いて、がんや免疫疾患を発見するPET診断薬の研究開発を進めています。特に、米国で臨床開発が進められている「89 Zr-Df-IAB2M」は、従来診断が困難であった、前立腺がんのリンパ節や骨への転移を造影することができる画期的なPET診断薬として注目されています。イマジナブ社は、日本においても本診断薬をはじめとしたバイオ医薬品の事業を展開するため、2014年5月に日本法人「イマジナブジャパン」を設立しております。
前立腺がんPET診断薬「89 Zr-Df-IAB2M」は低分子化抗体に半減期約3日の89Zr(ジルコニウムの放射性同位元素)を組み合わせたPET用診断薬で、前立腺がんの特異的膜抗原であるPSMA
(Prostate Specific Membrane Antigen) に選択して結合することで前立腺がんを造影することが可能。
「89 Zr-Df-IAB2M」は、現在米国FDAでの医薬品承認に向けて臨床第2相(PhaseⅡ)の開発段階にある。日本国内でも今後開発を進め、医薬品承認取得を目指す予定。
JFEエンジニアリングは、メディカル分野をエンジニアリングの新しい事業領域として注目しており、これまで全国35箇所の病院等の医療機関にPET診断用のサイクロトロン、合成装置を納入してきました。本診断薬は国内で初めて、放射性同位元素89Zr(ジルコニウム89)と低分子化抗体を組み合わせて開発が進められており、JFEエンジの製造技術やノウハウが最大限に活かせるものです。
サイクロトロンはガンマ線を発する放射性物質を製造し、合成装置はこの放射性物質と診断部位に集まる薬剤を原料としてPET診断薬を合成する装置。
両社は、日本における本診断薬を用いたPET診断の実用段階に備え、本診断薬の製造から医療機関への供給に関する一貫技術を確立すべく検討してまいります。
------------- 2015年1月2日 日経バイオテク
西村伸太郎=イマジナブジャパン代表取締役
PET診断では物理学的半減期の短い放射性薬剤を使用しますが、本剤では半減期が約3日 と物流的には比較的扱いやすい核種である89-ジルコニウムを用いており、院内製造施設が不要である利点 を持っております。薬剤標的であるPSMAは前立腺癌において、腫瘍の進展と相関することが示されており、特にホルモン療法抵抗性および転移性癌で高いレベルで発現していることが知られています。
本薬剤は原発巣のみならず骨転移、リンパ節転移などの造影も可能であり、現在米国でP2段階にあります。本剤が実用化されれば、高質な前立腺がんの診断が可能となるだけでなく、抗がん剤とのコンビネーションによる個別化医療の実現が期待されます。そのため治療薬を有する製薬企業や放射性核種製造企業との協働に取り組みたい所存です。
2016 年 1月 21 日 日立金属
米国・ 医療機器用部品会社の株式取得(子会社化)に関するお知らせ
当社は、電線材料事業における医療分野の強化とグローバルな中長期的成長を目指して、米国において医療用チューブ等事業 を展開するHTP-Meds,
LLC および Hi Tech Machine and Fabrication, LLCの全株式を、当社子会社の米州地域統括会社 Hitachi Metals
America, LLCが取得することで、HTP-Meds社およびHTMF社の株主と合意し株式譲渡契約を締結しました。
これにより当社は、電線材料事業の成長ドライバの1つと位置づける医療分野において、電線・ケーブル技術と親和性が高く、成長性のある医療用チューブ事業を当社事業に加えるとともに、医療ビジネスの中核的な市場である北米において事業基盤を確保できます。今後当社は、株式を取得する2社と当社の相互の事業基盤、顧客基盤を生かして既存の医療用製品を強化・拡大することはもちろん、それぞれの技術力を組み合わせた新しい製品を開発、展開することにより、医療用製品事業をグローバルに成長させてまいります。
1.株式取得の背景・目的鉄道、医療、自動車用電装部品 の3分野を成長ドライバと位置付け、ポートフォリオの入れ替えをすることで高収益事業体質の確立に取り組んでいます。
2013年 7月 日立電線(株)と合併、電線材料カンパニーを新設
日立製作所の中西宏明社長が主導した日立電線の救済策
日立製作所からの分離独立を早期に果した日立金属、日立電線、日立化成工業(2013年1月から日立化成)は日立系御三家と呼ばれる。
電線材料の事業ポートフォリオ見直し・基盤強化住友化学へ譲渡完了 )
エコー検査で用いる超音波診断装置の本体とプローブ(探触子)をつなぐケーブル。軽量で耐屈曲性や可とう性に優れ、かつ高い電気特性を兼ね備えており、取り扱いやすさと同時に画像の高精細化を実現し、医療機器の発展に貢献しています。
1.髪の毛よりも細く、強度と可とう性に優れた銅合金素線
社会インフラの整備、機器の小型化・高性能化に寄与する多彩な製品を提供
長年にわたる実績と豊富な経験を活かし、電力施設用から一般建設用・産業用に至るまで、社会インフラの整備に寄与する各種製品や、各種機器の小型化・高性能化に寄与する製品で、お客様に最適な提案を行っています。
自動車部品
自動車の安全性、省エネルギー、利便性の向上に貢献
市場のニーズに適応し、材料の特性を活かすことを基本に、エネルギーや信号を効率よく確実に伝える各種センサーや電源ハーネス、ブレーキ用ハーネス・ホースなどをグローバルに開発、生産、販売し、品質保証することで、お客様のニーズに対応します。
情報システム
特徴ある情報通信インフラ向け製品・ソリューションを提供
情報ネットワーク機器や携帯電話基地局のアンテナシステムなど、さまざまな製品や技術、ソリューションを提供しています。
しかしながら、事業を中長期的・持続的に成長させるためには、事業領域を拡大することに加え、医療ビジネスの中核的な市場であり、今後も高い成長ポテンシャルが期待できる北米において事業基盤を確立することが課題となっていました。HTP-Meds社は医療用チューブ を、HTMF社は医療用チューブ成形金型 を製造・販売しています。HTP-Meds社は、2005年の創業以来、カテーテルや人工透析などに用いられる医療用チューブにおいて優れた成形および加工技術を強みとし、米国を中心とした大手医療機器メーカーを顧客基盤として有しています。
Our custom medical tubing applications
and products include PORTs( )、PICCs( ),
dilators( 医療用 拡張器),
multi-lumen tubes, multi-layer tubes, precision tubing for balloons and
sheaths, catheters and more.
名 称 Hi-Tech Machine and Fabrication, LLC
2016/01/25
日東電工
創薬専業新会社(Nitto BioPharma, Inc.)の設立について
Nittoは、Innovation for
Customersをブランドスローガンに掲げ、Green(環境関連)・Clean(新エネルギー)・Fine(ライフサイエンス)の分野で事業ポートフォリオを拡大し、社会に価値提供していくことを目指しています。線維症をはじめとした難治性疾患の治療薬開発はFine(ライフサイエンス)における取組みになり、今回の新会社設立を契機に、これらの活動をさらに推進していく所存です。
■新会社の概要
日東電工 医療分野
核酸医薬品の原薬合成では、極少量の研究初期から治験後期まで対応できる設備と体制を整備し世界のトップシェアを維持しています。
経皮吸収型テープ製剤 薬を皮膚から吸収させ、体内に導く経皮吸収治療システム。
2012/11/13
核酸医薬分野の更なる事業拡大 米国「ギリンダス・アメリカ社」の資産買収契約を締結
日東電工は、日東電工アビシア社(100%子会社、所在:マサチューセッツ州ミルフォード市)を通して、今後成長が期待される核酸医薬の分野において更なる事業拡大を目的に、ギリンダス・アメリカ社と資産買収契約を締結しました。 なお、クロージングは2013年1月初旬を予定しております。
買収の狙い
核酸医薬は、DNAやRNAなどの核酸を構成成分とする医薬品で、遺伝子の発現に直接作用することにより、これまで治療が難しかった病気の治療が可能になると期待されており、抗体医薬に次ぐ医薬品として注目されています。
今回、当社はギリンダスの資産を買収することにより、今後の成長が期待される核酸医薬品業界において以下のようなシナジー効果を発揮し、更なる事業拡大とお客様のサービス向上を図ってまいります。
*1)cGMP:Current Good
Manufacturing
Practice((現行の)医薬品等の製品管理及び品質管理に関する基準、の略)。米国食品医薬品局の医薬品等の製造、試験に適用される品質管理システムのこと。
ギリンダス・アメリカ社の概要
1)社名
: Girindus America
Inc.
2)所在地
: 米国オハイオ州シンシナティ
3)従業員数
: 60人
4)事業内容
:
核酸医薬の受託製造において主要な製薬会社、バイオテック会社へのサービス提供の経験を有する。またRI標識能力及び有機合成能力を有する。
日東電工アビシア社の概要
1)社名 : Nitto Denko Avecia
Inc.
2)所在地 :
米国マサチューセッツ州ミルフォード市
3)従業員数 : 129人
4)事業内容
:
核酸医薬の受託製造においてトップシェアを誇り、前臨床試験用から商業生産まで幅広いサービスを提供する。
日東電工アビシアは、米国マサチューセッツ州、ミルフォード とオハイオ州、シンシナティにある核酸医薬の受託合成製造会社です。今後成長が期待される核酸医薬の分野において事業基盤の強化を目的に、核酸医薬の製造受託分野でトップシェアを誇るアビシアバイオテクノロジー社を2011年2月に買収して新たに設立しました。
日東電工アビシアは、前臨床段階から商業的施設までのステージにおいて、アンチセンス、siRNA、アプタマー、免疫賦活剤、miRNAおよびデコイ分子といった広範囲にわたる核酸医薬原薬を、FDAの検査
をクリアしたcGMP施設にて製造しています。
また、分析方法開発、プロセスバリデーション、安定性試験、品質管理及び薬事面サポートと幅広いサービスを提供しています。
ーーーーーーーーーーー
2011/02/04
核酸医薬分野の事業拡大を目指す 米国「アビシアバイオテクロノジー社」を買収
買収の狙い
アビシアバイオテクノロジー社は、核酸医薬の製造受託分野でトップシェアを誇り、前臨床段階から商業的製造までのステージにおいて、cGMP*)製造能力をベースに、分析方法開発、プロセスバリデーション、安定性試験、品質管理及び薬事面サポートと幅広いサービスを提供しています。今回、当社はアビシアバイオテクノロジー社を買収することにより、揺籃期にある核酸医薬業界において以下のようなシナジー効果を発揮し、更なる事業拡大を図っていきます。
*)cGMP: Current Good
Manufacturing
Practice((現行の)医薬品等の製品管理及び品質管理に関する基準の略)。米国食品医薬品局の医薬品等の製造、試験に適用される品質管理システムのこと。
核酸医薬分野における事業展開
核酸医薬は、DNAやRNAの機構成分である核酸からなる医薬品で、遺伝子の発現に直接作用することにより、これまで治療が難しかった病気の治療が可能になると期待されており、抗体医薬に次ぐ医薬品として注目されています。
日東電工テクニカルコーポレーション (100%子会社、本社:米国カリフォルニア州、社長:松本憲嗣)で核酸医薬合成の技術開発を行なっており、今回の買収で核酸医薬の製造受託事業を手に入れることにより、核酸医薬分野での事業基盤の強化を図って参ります。
アビシアバイオテクノロジー社の概要
1)社名 :アビシアバイオテクノロジー (英文 Avecia
Biotechnology Inc.)
2012年 アビシアバイオテクノロジーを日東電工アビシアに改名
2016 年6 月8 日 三菱ガス化学 / 日本化薬
抗体医薬品製造会社の設立について
社名 株式会社カルティベクス(Cultivecs Inc.)
設立年月日 2016 年6 月7 日
所在地 東京都千代田区(三菱ガス化学内)
工場所在地 新潟県新潟市(三菱ガス化学新潟工場内)
資本金 50 百万円(設立時)
出資比率 三菱ガス化学55%、日本化薬45%
事業概要 抗体医薬品製造の企画・受託
代表者 取締役社長 藤井 政志
1) 三菱ガス化学
三菱ガス化学のバイオ事業は1960
年代に開始した微生物タンパク質の生産研究に端を発し、ここで培った微生物の連続集積培養技術を基に、コエンザイムQ10
やピロロキノリンキノンなどの健康食品素材、特殊アミノ酸などの医薬中間体、カタラーゼなどの産業用酵素を製造販売している。
三菱ガス化学は2011年4月、台湾のバイオ医薬開発ベンチャーであるGlycoNex
Inc.( 台灣醣聯生技醫藥)とパートナー関係を結び、共同で抗体医薬品の開発業務受託機関(CRO)として同事業に参入した。
両社は2010年10月に技術導入契約を締結し、三菱ガス化学の研究員を GlycoNex に派遣し、技術導入を開始しているが、三菱ガス化学の 子会社の菱江化学を介してCRO
として事業を行うための業務委託契約を結ぶことで合意した。
CRO としてクライアントから受託した抗体医薬品の開発について、 GlycoNexが 抗体を生産する動物細胞の開発を、三菱ガス化学が当該動物細胞を利用した抗体製造プロセスの開発を担当する。
三菱ガス化学は、Q10
やピロロキノリンキノン、カタラーゼなどのバイオ関連製品の研究開発を通じて培ってきた培養精製技術を抗体医薬の製造に適用する。
三菱ガス化学は2014 年4 月2
日、抗体医薬品の製造プロセス開発等の受託事業を行う100%子会社 MGC ファーマを設立した。
2) 日本化薬
日本化薬は2013年5月、興和テバ(現
テバ製薬)と共同で開発を進めてきた遺伝子組換えヒト顆粒球コロニー刺激因子(G-CSF)製剤を発売し、がん領域のラインアップに加えた。
2014年7月4日、国内で最初の単クローン抗体のバイオ後続品インフリキシマブBS点滴静注用100mg「NK」の製造販売承認を取得した。
関節リウマチ、炎症性腸疾患等の自己免疫疾患治療において重要な役割を果たしているインフリキシマブ(遺伝子組換え)製剤のバイオ後続品で、2010年11月に韓国のCelltrion
グループと日本における共同開発・販売に関する契約を締結し、開発を進めてきたもの。
Celltrion
グループは世界初の抗体バイオシミラーである「Remsima」など多数のバイオシミラー及びバイオ新薬のパイプラインを保有する。
2016.8.2 日本触媒
TAK-Circulator株式会社との資本提携に関するお知らせ
日本触媒は、TAK-Circulator株式会社(本社:東京都文京区)が実施する第三者割当増資を、日本触媒が引き受けることで合意しましたので、下記の通りお知らせいたします。健康・医療事業を始めとする新規事業の早期立ち上げ・新製品の速やかな上市 を目指した
取り組みを行っております。創薬支援事業の確立 を目指した活動を進めており、市場の拡大が見込まれるペプチド医薬原薬 、DDS分野 への参入に続いて、新たな有望領域として核酸医薬原薬 への参入を検討しています。日本触媒は、こうした事業分野において、革新的なシーズを保有する企業等との提携の可能性を探し続けています。
ペプチド医薬:ヒトの体内で分泌されるホルモンなどの生理活性物質(アミノ酸の縮合体)を医薬品として応用するもの
TAK-Circulatorは東京大学保有の革新的な技術を駆使した皮膚細菌叢のゲノム解析
サービスであるマイクロバイオーム事業を展開するとともに、健康長寿を実現する核酸医薬の創薬を進めております。
皮膚細菌叢:人間の皮膚に常在している微生物の集合
今回の資本提携を通じて、日本触媒はTAK-Circulatorの核酸医薬シーズの開発を促進するとともに、同原薬の開発・製造の面で業務提携を実施するべく、今後両社で協議を進めて
参ります。21.42% を取得する予定であります。http://www.tak-circ.com/
ーーー
2019/9/10
TAK-Circulatorとの業務提携および第三者割当増資引受のお知らせ
日本触媒 は 、 TAK - Circulator 株式会社 と、 TAK - Circulator が開発した ステロイド抵抗 性 難治 重症喘息 ※ 1 を対象とした核酸 医薬品 「 TAKC - 02 ( 開発 コード )」 ( Gapmer 型アンチセンス核酸 ※ 2 ) について 、 共同商業化 契約を締 結 致 しました。 本剤は、 好中球や好酸球の遊走・浸潤に関与する 生理活性物質 を制御 し、 気道 炎症を抑制することが期待されます。 特に好中球性の重症喘息薬として は 初めての薬剤です。
また これを機に 、 TAK - Circulator の 第三者割当増資を引き受けるこ とで合意し、この たび 出 資 を 完了 致 しましたので 、 下記の通りお知らせ 致 します。
TAK - Circulator は、 東京大学保有の革新的な 研究シーズを事業化し、 皮膚細菌叢 解析サ ービスであるマイクロバイオーム事業と 、核酸医薬 等の 創薬事業を展開しています。
TAK - Circulator の核酸医薬創薬開発を促進すべく、 日本触媒 は 2016 年 8 月に 同社へ 出資 し、 資本提携 を 致しました 。以降、 核酸医薬の開発・製造の面で業務提携を実施するべく両社で協 議を進め 、 TAK - Circulator にて開発候補品 TAKC - 02 が創出されたのち 前臨床試験の準備が進 み 、 日本触媒においては 受託製造環境整備が進んだことで、このたび 共同商業化契約の締結 、 及び出資拡大 に至りました。 本提携 を通じて TAKC - 02 の 開発・ 早期実用化を推進し、社会へ の貢献を 目指します。
本 業務提携 では、 主に TAK - Circulator が 非臨床試験および臨床試験 の実施や承認申請を担 い、日本触 媒は治験 薬 製造、各臨床試験 、 および承認申請を支援することで、共同で TAKC - 02 の商業化を目指します。
GMP 原薬 の製造は、日本触媒から 2017 年 10 月に建設を 開始 し 、 2019 年 7 月に竣工式を執り行った中分子原薬合成施設で行う計画です。 当施設は 2020 年から GMP での 製造を本格的に 開始 致 します。
第三者割当増資の概要 日本触媒は、 TAK - Circulator が第三者割当増資により新たに発行する 普通株式 を以下の通 り引き受けま した 。これにより 日本触媒は TAK - Circulator の増資後の発行済株式総数の 35 . 28 % を取得し、出資比率が拡大します 。(現状
21.42%出資)
2016/10/12
日東電工
米国Irvine Pharmaceutical Services社及びAvrio
Biopharmacenticals社の資産を買収
核酸医薬分野の更なる事業拡大
日東電工は、日東電工アビシア社(100%子会社、米国マサチューセッツ州)を通して、医薬品の分析サービスを提供するIrvine
Pharmaceutical Services社(米国カリフォルニア州、IPS社)及び、医薬品無菌充填サービス提供するAvrio
Biopharmaceuticals社(米国カリフォルニア州、「Avrio社」)の資産買収を行い、新会社「日東アビシアファーマサービス社(Nitto
Avecia PharmaServices社)」を設立いたしました。Nittoは、本買収により得られる新たな分析・製造能力を最大限に活用し、今後市場拡大が見込まれる核酸医薬で更なる事業拡大を目指します。
<本買収の目的・意義>
分析サービス(分析法開発・分析バリデーション・安定性試験等)の拡充 核酸医薬原薬の供給に加え、最終製剤(無菌充填)製品の供給 核酸医薬最終製剤の設計サービス
Nittoは、Innovation for
Customersをブランドスローガンに掲げ、Green(環境関連)・Clean(新エネルギー)、Fine(ライフサイエンス)の分野で事業ポートフォリオを拡大し、社会に価値提供していくことを目指しています。“Fine(ライフサイエンス)”の取組である本買収を契機として、お客様の核酸医薬開発を更に加速させるサービスを今後も提供してまいります。
社名:Irvine Pharmaceutical
Services 所在地:米国カリフォルニア州アーバイン市 従業員数:約130人
事業内容:製薬会社、バイオテック会社への試料分析、製剤開発、安定性試験、分析法開発等のサービス提供
<Avrio Biopharmaceuticals社の概要>
社名:Avrio Biopharmaceuticals 所在地:米国カリフォルニア州アーバイン市 従業員数:約40人
事業内容:医薬品の無菌充填(フィル&フィニッシュ)、製剤設計等のサービス提供
<日東電工アビシア社の概要> 2011/2 Avecia
Biotechnology Inc. を買収して 設立
社名:日東電工アビシア(英文 Nitto Denko
Avecia Inc.) 所在地:米国マサチューセッツ州ミルフォード 従業員数:約290人
事業内容:20年以上の経験を誇る業界No.1核酸医薬製造・開発支援企業。前臨床から商業化のステージまで、高い製造プロセス設計能力とcGMP*1) 製造能力をベースとしたサービスを提供し、業界トップシェアを誇る。
*1) cGMP: Current Good
Manufacturing
Practice((現行の)医薬品等の製品管理及び品質管理に関する基準、の略)。米国食品医薬品局の医薬品等の製造、試験に適用される品質管理システムのこと。
------
2016/10/12 日本経済新聞
日東電工はがんなどの治療に使うバイオ医薬品の分野で米国2社を合計50億円程度で買収した。新たに最終加工や瓶詰めまで一貫生産できる体制を整え、供給までのスピードや効率を高める。自社の生産ラインも2017年6月までに米国で増強する。主力の電子部品事業が苦戦するなか、成長の柱に掲げる医薬品事業への投資を拡大する。
生産するのはバイオ医薬品の中でも新しいタイプの「核酸医薬品」。世界で開発競争が激化している。人工的に合成したDNAなどを使うのが特長だ。病気の原因となる遺伝子の働きを直接抑えることができ、高い薬効が期待されている。
日東電工は臨床試験を進める製薬大手などからDNAの合成を受託しており、同分野の世界シェアは約6割。11年に素材の供給先だった米企業を買収し、核酸医薬品の合成事業に参入していた。
今回買収した1社、アーバイン(カリフォルニア州)は、日東電工が合成した粉状の「原薬」などの分析や使用期限の試験をする。もう1社がアブリオ(同)で、液体状に加工し、瓶詰めする。
一方、日東電工は米マサチューセッツ州にある自社の合成工場を拡大する。新ラインを設置することで能力を数倍に高める。投資額は数十億円とみられる。
同社の医薬品を含むメディカル・メンブレン事業の営業利益は16年3月期に111億円と、前の期比4.6倍に急拡大した。17年3月期は5割増の170億円を見込む。スマートフォン(スマホ)の販売減で液晶部材などの電子部品事業が苦戦する中で、医薬品事業を成長の柱に掲げている。
2016/11/02 日東電工
世界初の革新的なワクチン投与のプラットフォーム構築へ
季節性インフルエンザHAワクチン舌下錠の第Ⅰ相臨床試験を開始
本ワクチンは舌下に投与し唾液で溶ける錠剤であり、Nittoが独自に開発した新規プラットフォーム(新規アジュバント<免疫誘導を促進させる物質>を用いた舌下投与型製剤)を採用し、体内に侵入して増殖したウイルスを撃退するだけでなく、体内にウイルスが侵入すること自体を防ぐ効果が誘導できると期待されています。
既存注射剤にはないウイルスの感染自体を防ぐ効果 がある 舌下に投与 するため、投与時の痛みが無い常温での保管 が可能
今後本ワクチンの一日も早い実用化を目指すとともに、ワクチン分野における本プラットフォームの幅広い展開を図っていきます。
Nittoは、Innovation for
Customersをブランドスローガンに掲げ、Green(環境関連)・Clean(新エネルギー)、Fine(ライフサイエンス)の分野で事業ポートフォリオを拡大し、社会に価値提供していくことを目指しています。薬の投与方法における新規プラットフォームを構築し、予防段階から人々の暮らしに貢献するワクチンの開発はFine分野の取り組みの一つとして、できるだけ早く医療現場に提供できるよう努めてまいります。
一般財団法人阪大微生物病研究会は、大阪大学微生物病研究所における先駆的基礎研究をもとに、ワクチンの研究開発、製造・供給を行っている法人です。
ーーー
ワクチン大手で一般財団法人の阪大微生物病研究会(大阪府吹田市)と共同で開発する。新型ワクチンは舌の下に置き唾液で1分程度で溶かしてから体内に取り込む。ウイルスの入り口である鼻などの粘膜上にも抗体を作りウイルスの侵入を防ぐ。体内にしか抗体を作れない注射法より高い効果を動物実験で確認できたという。投与が容易になり医療技術者が不足する災害現場などでの使用にも適している。
従来の注射剤の液体ワクチンは冷蔵で1年しか保存できない。新ワクチンは常温で数年間、セ氏40度でも6カ月間保存できる。これまで輸送が難しかった温暖な地域にワクチンを届けられる。
阪大微研がワクチンのもとになる抗原、日東電工が細胞に働きかけて抗体の生成を促す補助剤を担当する。口の中は食事などで異物を取り込むため免疫機能が起きづらく、補助剤なしには抗体ができないという。日東電工が持つ、錠剤にして効果を安定させる技術も活用する。
日東電工と大阪大学・京都大学の研究グループは、免疫活性化物質
IP-PA1(Immunopotentiator of Pantoea
agglomerans 1)は 舌下投与するとインフルエンザワクチンによるインフルエンザ抗体の産生を増強することを初めて報告している。
IP-PA1は、生体内に侵入した細菌やウイルス,死んだ細胞を捕捉,分解するマクロファージのTLR4受容体に結合することでマクロファージをを活性化する
。
2019/3/15
米ファンドブラックストーン、あゆみ製薬を買収
米大手投資ファンドのブラックストーン・グループは15日、鎮痛剤の「カロナール」などを主力品とするあゆみ製薬を買収すると発表した。負債を含む買収規模は1000億円前後になる見通し。ブラックストーンは2018年から日本市場で企業投資事業を本格展開しており日本での1号案件となる。
エムスリーと投資ファンドのユニゾン・キャピタルが保有するあゆみ製薬株を全株買い取り、ブラックストーンの出資比率は100% になる。買収手続きは2019年4~6月中の完了を見込む。ブラックストーンは豊富な資金力を生かし、今後も医薬分野で追加的な買収を進めていく。
あゆみ製薬は2015年に参天製薬の抗リウマチ薬事業と昭和薬品化工の医科事業を承継して設立された。解熱鎮痛剤の「カロナール」などが主力薬。ブラックストーンが海外で投資しているバイオ医薬領域の製品を日本市場で展開するうえでの受け皿として活用し、企業価値の向上を狙う。
あゆみ製薬は、2015 年1月に発足。主要株主はユニゾン・キャピタルがアドバイザー等を務める投資ファンド
2015年8月に参天製薬の抗リウマチ薬事業を、同じく2015 年12月に昭和薬品化工の医科事業(カロナール:鎮痛薬等)を承継した。
リウマチ・整形外科の領域に特化したスペシャリティファーマとして事業を展開している。
バイオシミラーへの参入は、売上500億円を早期に達成するに当たっての重要な戦略となっており、第1号製品としてインフリキシマブBS「あゆみ」の上市を果たした。日医工子会社のヤクハン製薬と共同開発で、あゆみが単独販売する。
2019年11月25日
旭化成
米国 Veloxis Pharmaceuticals Inc.の買収について
~ グローバル・ヘルスケア・カンパニーへの進化を加速 ~
旭化成 は、米国の製薬企業であ る
Veloxis Pharmaceuticals Inc.(本社:米国ノースカロライナ州 )を
100%保有している Veloxis Pharmaceuticals A/S( Veloxis
DK、 本社:デンマーク
コペンハー ゲン)
に対し、当 社のデンマーク子会社による株式公開買付け(デンマーク法に基づく公開買付け) を行うことにより、Veloxis
社を買収することを本日決定いたしましたので、お知らせ いたします。
当社は本公開買付けにより、Veloxis DK 社の発行済普通株式およびワラントの総数を総額約89億デン マーククローネで取得します。
本買収は友好的なものであり、当社およびVeloxis DK社の取締役会は本 買収を既に承認しております。また、Veloxis
DK 社の上位 2株主( Lundbeckfond
Invest A/S
36.6%、 Novo
Holdings A/S
36.6% )、Veloxis
DK 社の取締役および経営陣、 ならびに
Veloxis 社の経営陣(以上合計で完全希薄化後の発行済株式の約81.2%を保有)から本公開買付 けに応募する旨の同意を得ております。
なお、本買収完了のためには、独占禁止法に基づく条件の充足 その他一般的な前提条件を満たすことが必要になります。
1.Veloxis 社買収の意義
(1) 当社におけるヘルスケア領域の位置づけ
当社は 1922 年の創業以来、時代の変 化に応じた社会課題の解決に取り組むことで成長を 遂げてきました。本年スタートした中期経営計画「Cs+
for Tomorrow 2021」においては、 持続可能な社会への貢献の
1 つとして、健康 長寿社会へ の価値提供を方針に掲げています。
また、ヘルスケア産業は、高齢化が進む先進国で安定的な 成長が予測され、 当社グループ の成長に欠かせない事業領域です。
当社は、健康 長寿社会 への貢献にあたっては、ヘルスケアに関わる多面的な価値提供が重 要だと考えており、医薬品、医療機器の両分野で豊富な経験、ノウハウおよびリソースを所 有しています。
ヘルスケア領域は、既存事業のオーガニックな 成長に加え、 ZOLL
買収によるクリティカ ルケア事業の獲得という非連続的な 成長 を実現した結果、当社グループの売上高の15%、営 業利益の19%(2018
年度実績)を占め、中核事業の1つとなっています。
(2) 買収に至った背景
当社は、ヘルスケア領域の長期的な成長の為 、 多様な成長力・競争力を組み合わせ、医薬 事業と医療機器事業の両輪において「グローバル・ヘルスケア・カンパニー」としての進化 をさらに加速することが必要だと考えています。
特に、世界最大の市場であり、かつイノベーションの発信地である米国においては、 長年 に渡って事業展開強化に取り組んできました。
医薬事業の米国展開においては、以下を満たす事業基盤の獲得機会を模索してきました。
1)
当社がこれまで蓄積してきた経験、ノウハウを活かすことができ、かつ高度医療など高 いアンメットニーズがある分野を手掛けていること
2) 当社グループで引き続き当該事業の経営を担い、独自の強みを生み出すことで事業を成 長させたいと考え る人財がいること
Veloxis 社が販売している製品は、当社が知見を有する腎移植手術患者向けの免疫抑制剤 で あり、独自のドラッグデリバリー技術を活用することで、アンメットニーズを満た すとともに、他社製品との差別化が図られています。また、CEO
をはじめとする経営陣は、 高度医療向けに特化した製薬企業を複数経営してきた経歴を持つ人財であり、買収後も引き 続き経営を担い、同社の成長に意欲を示しています。
当社のヘルスケア領域は、2012 年の ZOLL 買収で示されるように、買収先企業が保有す る事業資産や人財を最大限活用することで、 高い成長を実現してきました。 本買収において も、Veloxis
社が保有する事業資産や人財の活用によって、グローバル・ヘルスケア・カンパ ニーへの進化を加速できると判断しました。
(3) 買収の狙い
当社は、米国医薬品市場における事業基盤を獲得し、両社の医薬事業の価値を最大化する ことで、医薬品・医療機器の双方においてグローバル化を進化させます。これを通じて、ヘ ルスケア領域のさらなる成長、 ひいては当社の持続的な企業価値向上に寄与します。
本買収のシナジーとして、当社は以下の実現を目指します。
・両社の事業基盤(当社:日本・アジア、Veloxis 社:米国)を活用したライセンス活動等 の活性化による、 新たな成長ドライバーとなる医薬品の獲得機会増加
・当社の創薬研究力と Veloxis 社の米国市場における医療ニーズの把握力を組み合わせる ことによる、高いアンメットニーズを満たす新薬の創出
・米国のイノベーション・臨床現場へのアクセスを活用したヘルスケア関連新事業の創出
(注 1) 体内での薬物動態(吸収・分布・代謝・排泄)をコントロールすることで、薬物の効果を高め、 副作用を抑えることを目的とした技術
公開買付けに要する資金
総額約 89 億デンマーククローネ(約 1,432 億円)
2019 年 10 月25日 協和発酵バイオ
防府工場における 製造出荷停止 のお知らせと お詫び
弊社 では、 2018 年アメリカ食品医薬局 (FDA) より Warning
Letter の発出を受け、防府工場にお いて品質保証体制の見直しと改善に取り組んでおります。
FDA の指摘事項は 、 アメリカ向け医薬品原料の分析試験手順 の不備 やデータ完全性の確保 につい て のもの ですが、 調査を進める中で、 いくつかの品目について 承認時に定められた製造手順と異なる 製造 が行われていた 事実が 見つかっ たことから、 9 月より 自主的に 製造 ・出荷 を 一時 中断し、 全品目について 製造手順の確認と 品質影響 評価 を行っております。
これまでの調査で 、 弊社が 協和キリン社に供給している 抗悪性腫瘍剤 原薬 (マイトマイシン C ) につい て 、 製造過程において 無菌性 の確保に影響しうる事実 が判明し、協和キリン社が同原薬を使用した 製 品の無菌性を保証できないと判断し、同製品の 自主回収 が 決定されました 。
防府工場で製造している その他の製品については、 包括的に 品質 および安全上 問題ないことが確認できており、 現在、品質影響 評価の最終的な 報告書を作成している段階で す。
当案件につきましては、事態を把握後速やかに関係当局に報告し、その後も関係 各所 と相談しながら 対応を進めて おります が、 患者様をはじめ、関係者の皆様方 に 多大なるご迷惑とご心配をおかけしている こと、 重ね て 深くお詫び申し上げます。
ーーー
2019 年 12 月 24 日 協和発酵バイオ
山口県による当社への 行政処分に ついて
(上記の通り) 弊社防府工場は、 昨 年アメリカ食品医薬局 ( FDA )より Warning
Letter の発出を受け、品質保証体制の 見直しと 、改善へ向けた取り組みを進める中で、 標準作業手順書で 定められた製造手順 と異なる 製造 が行われ ていた事実が見つかっ たことから、 9 月より自主的に製造・出荷を中断し、 全品目について 製造手順の確認と 品 質影響 評価 を行って まいりました 。
本日 、本件につきまして山口県より 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律 (医薬品 医療機器等 法 ) に 基づく 行政処分(業務停止ならびに業務改善命令)を受けましたのでお 知らせいたします。
<処分内容>
1. 医薬品製造業に係る 18 日間の業務停止 (令和元 年 12 月 2 5 日( 水 曜日)から 令和 2 年 1 月 1 1 日( 土 曜日)まで ) 医薬品製造業に係る業務改善命令 業務改善命令の内容 違反に 至った原因を究明し、医薬品の製造管理及び品質管理において、 以下の事項を含め、 医薬品 医 療機器等 法第 18 条第 2 項の規定に基づく GMP 省令その他関連法令を遵守するよう、 組織体制を見直 し、 改善のための是正措置及び再発防止策を講じること。
( 1 ) 今回の行政処分の原因となった 違反 行為について、 経営層を含めた各責任者の責任を明確にすること。 2 )医薬品製造管理者が 医薬品医療機器等法 及び GMP 省令等に基づく管理を適切に行える体制とす ること。 3 )製造管理及び品質管理を適正かつ円滑に実施しうる能力を有する責任者を適切に置き、適正に管理 を行わせること。 4 )製造管理及び品質管理に係る業務に従事する職員に対し、継続的に必要な教育訓練を行い、 医薬 品医療機器等 法及び GMP 省令を遵守させること。
<処分理由> 弊社防府工場において、 医薬品製造販売承認書、原薬等登録原簿又は輸出用医薬品製造届と異なる製 造方法で医薬品の製造を行ったため。(医薬品医療機器等法第 18 条第 2 項の規定に基づく医薬品、医療 機器等の品質、有効性及び安全性の確保等に関する法律施行規則(昭和 36 年厚生省令第 1 号)第 96 条に違反)
なお、 抗悪性腫瘍 剤原薬マイトマイシン C (現在本原薬を使用した同社製剤マイトマイシン注用 2mg および 10mg を自 主回収中) につきましては、無菌性の確保に影響しうる事実が判明しましたが、それ以外の 製品において は 、 弊 社製品を用い た 医薬品を 製造販売 されております医薬品製造販売業者 様 の ご協力も得て 、 品質および 安全上 問題ないことが確認できました。
2020 年 11 月 16 日 デンカ
インフルエンザワクチン原液製造新棟を竣工
デンカ は、五泉事業所(新潟県五 泉市)において、インフルエンザワクチンの原液製造用新棟を竣工いたしました。
当社はインフルエンザワクチンを製造する国内主要メーカーとして、増加する予防接種の社会的 ニーズに応えるため、 2018 年 7 月にインフルエンザワクチンの生産能力増強を決定いたしました。 今後、関係者の協力を得ながら安全最優先のもと、各設備の検証や試運転を行い、 2022 年シーズ ンから稼働し、生産量の増加を図ります。
当社は、経営計画「 Denka
Value-Up 」においてヘルスケア領域を重点分野と位置づけておりま す。
インフルエンザワクチンならびに新型コロナウイルスを含む各種ウイルス抗原迅速診断キット (「クイックナビ™」シリーズ)を製造・販売する国内唯一のメーカーとして、感染症対策を社会 的責務と捉え、予防・検査体制の拡充および人々の QOL 向上に貢献してまいります。
建設場所:五泉事業所 新潟工場内 ( 新潟県五泉市 )
2,226 ㎡、延床面積: 12,010 ㎡、地上 6 階建て 2022 年シーズン供給開始(予定) 160 億円(関連設備を含む) ( 新潟工場
36
号棟 ) の
2
倍
2020/11/11 デンカ、本年度決算で新型コロナ検査キットが貢献
2020.11.11
日経デジタルヘルス
治療用アプリが国内初の保険適用、初回診療時に2万5400円分を算定
厚生労働省の中央社会保険医療協議会(中医協)は2020年11月11日の総会で、CureApp社のニコチン依存症を対象とした治療用アプリと一酸化炭素(CO)チェッカー の保険適用を了承した。12月1日に保険適用され、医療機関での処方が可能になる見込み。CureApp社長の佐竹晃太氏は「最初の風穴を開けた。意義深いと考えている」とコメントした。
CureAppの治療用アプリとCOチェッカーは新技術の区分で保険適用が了承された。医療機関は、ニコチン依存症の治療でCureAppの治療用アプリとCOチェッカーを利用する場合、初回の診療時に2万5400円分の保険点数を算定できるようになる。内訳は医療従事者が治療用アプリとCOチェッカーの適正使用を促す管理料として1400円、治療用アプリとCOチェッカーそのものに対して2万4000円。
中医協総会では、議論に参加した委員から「初回の診療で保険点数を算定できるようになっているが、途中で脱落する患者もいるだろう。最後の診療時に算定するなど、アウトカム(成果)を重視した仕組みが必要ではないか」「複数の企業が行動変容を促すアプリの開発を進めており、今後増えていくだろう。治療用アプリの診療報酬の決め方について議論すべきだ」などの意見が挙がった。
今回の治療用アプリ は患者がログインに必要なコードを入力しないと起動しない仕組みになっており、治療開始時に、医師が患者にコードを発行する。患者が自分の気分や服薬状況などを入力すると、個別化された治療ガイダンスがアプリ上で配信される。
呼気中のCO濃度 を定期的に計測した結果も、治療ガイダンスに反映される。医師は医師用アプリから呼気中のCO濃度などのデータを確認し、診療時の補助として活用する。
CureAppは2014年7月に創業した(創業時の社名はキュア・アップ)。2017年10月にニコチン依存症の治療用アプリの治験を開始し、2018年12月に完了。2020年8月に厚労省からニコチン依存症の治療用アプリの薬事承認を得ており、保険適用の行方に注目が集まっていた。
ーーー
CureApp ソフトウェアで「治療」を再創造する Re-evolving
“therapeutics” with software
CureAppは、進化するテクノロジーを活用した新しい治療を生み出すことで医療を取り巻く社会課題を解決し、全ての人が安心して質の高い治療を受けられる理想の医療を実現します。
主要株主
Beyond Next
Ventures、第一生命保険、慶應イノベーション・イニシアティブ、伊藤忠テクノロジーベンチャーズ、森トラスト、SBIインベストメント、CYBERDYNE、三菱UFJキャピタル、伊藤忠商事、いわぎん事業創造キャピタル、みずほキャピタル、インテージホールディングス、コシダカホールディングス、セゾン・ベンチャーズ、ちばぎんキャピタル、役員等
2021/8/24 北海道大学
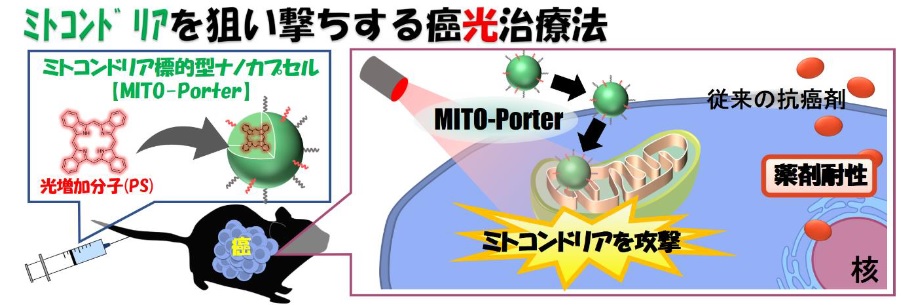
を狙い撃ちする 癌 光治療 法 の 開発 に成功
~ 副作用の少ない癌治療を , ミトコンドリアに薬を運ぶ技術開発で! ~
ポイント
・ 癌 光治療用 のミトコンドリア標的型 ナノカプセル の開発に成功。
・ 担癌 モデルマウスを用いた治療効果の検証実験において , 単回 投与で癌 細胞 の成長 を 著しく 抑制。
・ミトコンドリアを狙った 薬剤耐性 癌の新しい治療 法 の開発に期待。
概要
北海道大学大学院 薬学 研究院の 山田勇磨准教授 , 原島秀吉教授と電子科学研究所の高野勇太准教授 らの研究グループは , 光増感分子
( Photosensitizer,
PS ) を 搭載したミトコンドリア標的型ナノカプセ ル の構築に成功し,ヒト由来の癌を担持するマウス を用いた検証実験を行い,「ミトコンドリアを狙 い撃ちする癌光治療戦略」の有用性を示すことに成功しました。
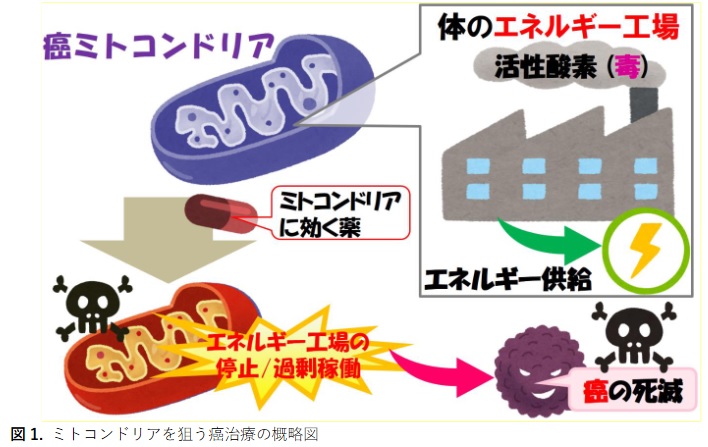
癌 光 治療は , 患部切除を行わずに選択部位の癌組織を死滅させるため , 患者の身体的負担が少ない 治療法として期待されてい ます。一方で, 現状の光治療法では , 殺しきれなかった癌細胞が増殖 することによる耐性癌発生リスク があり , それを解決する治療法の開発が望まれてい ます。そこで研究グ ループは, 癌細胞のエネルギー工場であるミトコンドリアを破壊 する新たな癌光治療の検証を 試みま した。
光照射によってミトコンドリア内で活性酸素発生を誘導 する
PS
(rTPA,
特願
2018 - 172698) を , ミトコンドリア 型ナノカプセル
( MITO - Porter ,
特許第
5067733
号 ) を用い , ヒト舌癌細胞( SAS
cell ) のミトコンドリアへ送達 しました 。 SAS
cell
を皮下移植した担癌 モデルマウスを作成 ・ 評価した結果 , MITO - Porter
(rTPA) 投与 ・光照射群において , 癌 の 増殖 を著しく抑制する 治療 効果を観察し ました 。
本研究で採用する「ミトコンドリアを 狙い撃ち する癌治療戦略」は既存薬の抗癌作用機序と異なり, 薬剤耐性 癌の治療にも有用であると期待されます。 また , 癌細胞にピンポイントに抗癌剤を運ぶナノ カプセルは正常細胞への侵襲性を抑えることが期待されるため,「効果がでているのに副作用で治療 を断念」などの問題点の解決にもつながる可能性があります。さらに ,多彩な機能を有するミトコン ドリアを標的とした創薬開発の医療用ナノカプセルの基盤技術として も 貢献できると期待されます。
本研究成果は, 2 02 1
年
8
月
21
日( 土 )公開の
Nanoscale Advances
誌に掲載されました。
【背景】
癌光治療は,患部切除を行わずに選択部位の癌組織を死滅させるため,患者の身体的負担が少ない 治療法として期待されています。
参考 2020/7/1 楽天メディカル、「がん光免疫療法」の医薬品と医療機器の承認申請
しかし現状の光治療法の原理では,殺しきれなかった癌細胞が増殖 することによる耐性癌発生のリスク問題があり, それを解決する治療法の開発が望まれています。 抗 癌剤の多くは , 癌細胞の遺伝子が保存されている「核」を攻撃して , 癌細胞をやっつけます。核に抗 癌剤が運ばれると細胞の部品(遺伝子に作り方が書かれている)を作る活動が停止するため , 癌細胞 の成長が止まります。しかし , 薬剤耐性を獲得した癌をやっつけるためには , 核以外を標的とする必 要があります。
【研究手法】
本研究は,癌細胞のエネルギー工場であるミトコンドリアを破壊する新たな癌光治療の検証を試み ました(図
1 ) 。 ミトコンドリアは , 細胞のエネルギー工場ですので , 癌細胞のミトコンドリアを破壊 すれば , 癌の活動はストップ します【エネルギー工場の停止】。
また , エネルギー工場であるミトコン ドリアでは , 細胞の毒にもなる活性酸素(工場の煙)が排出されています。そのため , 活性酸素を増 加させるような薬をミトコンドリアに運んで癌細胞を破壊する作戦もあります【エネルギー工場の過 剰稼働】。
狙い撃ちする 癌治療』は , これまでの抗癌剤とは効き方が違うので , 新 しい治療の選択肢を提供する事ができると 期待しています。
私たちはこれまでに,ミトコンドリア標的型ナノカプセル( MITO - Porter )を利用して , 薬剤耐性 の ある癌細胞のミトコンドリアに抗癌剤を運ぶ研究を進め , 細胞実験で一定の成果を得ています
( Yamada
et al ,
J Pharm Sci
106: 2428 - 2437
(2017) ) 。
『ミトコンドリアに薬を運ぶ技術』は日々進化 しており,体の中の,癌細胞の,ミトコンドリアへ,薬を届ける事を目標に研究を進めて き ました
(Yamada
et al ,
J Pharm Sci
109: 2493 - 2500
(2020)) 。
今回の研究では , 光増感分子
( Photosensitizer,
PS ) を 搭載した
MITO - Porter
を構築し,ヒト由来の癌を担持するマウスを用いた検証実験を行い,「ミ トコンドリアを狙い撃ちする癌光治療戦略」の有用性を動物実験で実証する こと に挑戦しました。
【研究成果】
本研究では , PS
として近赤外
(700nm) の光照射によってミトコンドリア内で活性酸素発生反応を 誘導し 得る ポルフィリン骨格を有する 独自の 新規化合物
(rTPA,
特願
2018 - 172698) を選択し まし た。
また , 分子送達に関しては , 私たち が開発したミトコンドリア 標的型ナノカプセル , MITO - Porter
( 特 許第 5067733 号 ) を用 いました。ミトコンドリアに r TPA を運ぶために , r TPA を搭載した M ITO - Porter
(MITO - Porter
(rTPA)) の 構築 を検討し , ナノサイズの粒子を 調製 することに成功し まし た
( 粒子径:
1 00
-
200
nm,
ζ電位 :
+ 30 ~ 40
mV ) 。
モデル癌細胞として使用した ヒト舌癌細胞( SAS
cell ) に蛍光標識を施した
rTPA - MITO - Porter
を 添加し , ナノカプセルの細胞内局在を蛍光顕微鏡で観察しました。 その結果 , rTPA - MITO - Porter
が ミトコンドリア に集積する様子が観察され, M ITO - Porter
による
r TPA
のミトコンドリア送達が 確認 できました。 一方で, 陰性 コントロールナノカプセル (ミトコンドリア標的能がない) を利用した場 合には, ミトコンドリア への集積は観察されませんでした。
続いて , rTPA - MITO - Porter
を
SAS cell
に添加 し , 光照射後に
WST - 1
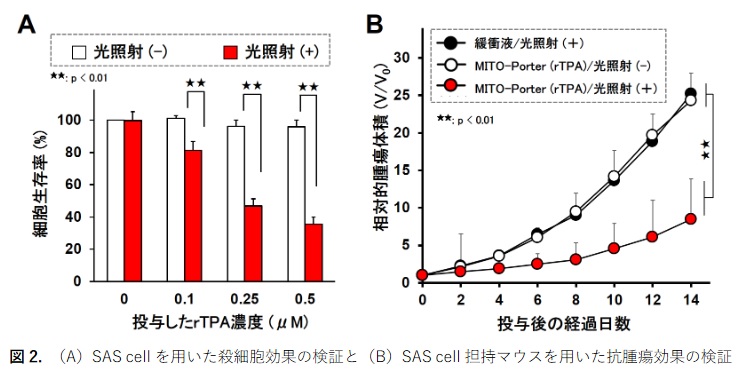
アッセイを用いて細胞生存 率を算出し ,癌治療効果を検証しました。図
2 A
のグラフでは , rTPA - MITO - Porter
投与 時の細胞生存 率を縦軸に示しており , 赤色 の 棒グラフ で 示す光を照射した群で は , r TPA
投与量に依存して細胞生 存率が減少 することを 確認しました。一方で , 光を照射しない場合 ( 白色 の棒グラフ) には細胞毒性 は確認されませんでした。
SAS cell
を皮下移植した担癌モデルマウスを作成し , MITO - Porter
(rTPA) 投与・光照射後の抗腫瘍 効果を継時的に評価し ました (図
2 B ) 。その結果 , MITO - Porter
(rTPA) 投与 ・光照射群において , 癌 細胞 の成長を著しく抑制する抗腫瘍効果を観察 しました 。 これらの研究成果 は , 癌ミトコンドリアを 標的とする 癌 光 治療 の有用性を 示し て い ます。
【今後への期待】
本研究で採用する「ミトコンドリアを狙い撃ちする癌治療戦略」は既存薬の抗癌作用機序と異なり, 薬剤耐性癌の治療にも有用であると期待されます。また , 癌細胞にピンポイントに抗癌剤を運ぶナノ カプセルは正常細胞への侵襲性を抑えることが期待されるため,「効果がでているのに副作用で治療 を断念」などの問題点の解決にもつながる可能性があります。さらに,多彩な機能を有するミトコン ドリアを標的とした創薬開発の医療用ナノカプセルの基盤技術としても貢献できると期待されます。
2021/8/26
北海道大学、ダイセル、北海道情報大学
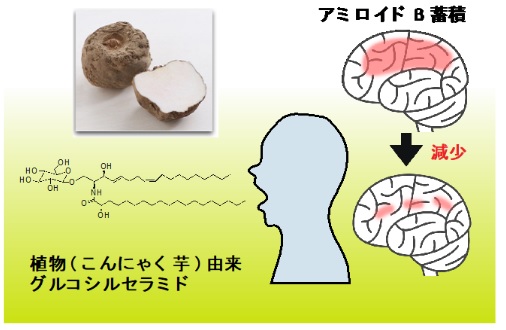
認知症予防にはこんにゃく由来グルコシルセラミドが効果的
第 75 回日本栄養・食糧学会 大会 に て 発表
~植物セラミドでヒト脳内アミロイド ß
蓄積抑制を確認~
ポイント
・植物セラミド摂取により脳内アミロイド ß
蓄積が減少 することをヒト介入試験で確認。
・認知症予防目的の機能性食品素材や新薬開発に期待。
北海道大学大学院先端生命科学研究院の五十嵐靖之客員教授,門出健次教授, 湯山耕平特任准教授 らの研究グループは,株式会社ダイセル,北海道情報大学健康情報科学研究センターと共同でヒト介 入試験を実施し,植物由来セラミドが脳内アミロイド ß
ペプチド* 1 ( Aß )蓄積を軽減 させることを発見しました。
*1 アミロイド ß ペプチド ... アミロイド ß
前駆体タンパク質(APP)から切断されて産生される約
40アミノ酸からなる生理的ペプチド。アルツハイマー病では,このペプチドの過剰な蓄積がアルツハイマー病発症の引き金と考えられている。
我が国では認知症患者数は
400
万人を超え,そのうちの
60% 以上を占めるアルツハイマー病の予 防法・治療法の開発は喫緊の課題となっています。アルツハイマー病の発症原因の一つは, Aß
が脳 内に過剰に蓄積することとされており,その蓄積抑制は予防を目的とした先制治療薬や機能性食品素 材の開発戦略の一つとなっています。
研究グループはこれまでに,こんにゃく芋から精製した植物由来グルコシルセラミド をアルツハイ マー病モデルマウスに経口投与することで,アミロイドβ除去効果をもつ神経細胞由来エクソソーム *2 が増加し,脳内アミロイドβ蓄積が減少することを明らかにしてきました。
*2 エクソソーム ... 様々な種類の細胞から分泌される直径
50〜150nm 程度の細胞外小胞。特定の分子を包含し,細胞間で受け渡すキャリアーの役割を担う。神経細胞由来エクソソームは表面膜の糖脂質でAß
を捕捉しグリア細胞に運搬することでAß 分解を促進させる。
今回は,ヒトにおける植物セラミドの効果を検証するため高齢健常者を対象に介入試験を実施し, プラセボまたは植物グルコシルセラミドを摂取した両グループにおいて,脳内 Aß
蓄積と相関する血 中バイオマーカー値を測定したところ,グルコシルセラミド摂取群において摂取前との比較で摂取後 に有意な低値を示しました。さらに層別解析を行ったところ,脳内 Aß
蓄積が相対的に低めの集団に おいて,グルコシルセラミド摂取群ではプラセボ群より有意に低値を示しました。この 研究成果から, 植物セラミドはアルツハイマー病の予防・治療への活用が期待されます。
本研究成果は, 2021
年 8
月 30
日(月)公開の『薬理と治療』 (2021
年 49
巻 8
号 ) に掲載される予 定です。なお,本論文は 2019
年公開の Scientific
Report(2019
年 9
巻1号 ) に掲載されたモデル動物 を用いた研究成果の続報です。
こんにゃくセラミドの アミロイド
ß ペプチド蓄積抑制効果
【背景】
アルツハイマー病( AD )は主要な老年期の認知症性疾患であり,現在早急な予防法・治療法の確立が 望まれています。 AD
発症には様々な要因が関与していますが,脳内での
Aß
蓄積増加が主な原因と考 えられており,脳内 Aß
レベルを制御することが予防・治療戦略の一つとして有望視されています。
研究グループはこれまでに,植物(こんにゃく芋)由来のグルコシルセラミドをアルツハイマー病モ デルマウスに経口投与することで, Aß
除去作用をもつ細胞外小胞エクソソームが脳内で増加し, Aß
濃 度が低下し,アミロイド沈着が軽減することを実験で明らかにしてきました。
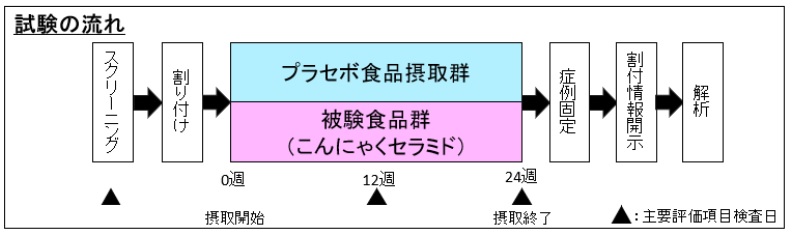
これらの成果をうけて,このたび,ヒトにおける植物グルコシルセラミド経口摂取の効果を検証する ため,北海道大学,株式会社ダイセル及び北海道情報大学の共同研究においてプラセボ対照ランダム化 二重盲検試験を実施しました。
【研究手法】
試験期間を 24
週間とし, 60
歳以上 80
歳未満の被験者 20
名(平均 70.1
歳)をプラセボ食品摂取群 10
名と被験食品(こんにゃくグルコシルセラミド ) 摂取群 10
名に構成し,プラセボ対照ランダム化二重 盲検並行群間比較試験を行いました。それぞれの群にプラセボ食品,またはグルコシルセラミド 5.4mg を含む被験食品を摂取してもらい, 0
週, 12
週, 24
週目 に,脳内 Aß
アミロイド蓄積レベルをモニター 可能な血漿アミロイド ß
バイオマーカー* 3
値の測定を実施しました(図 1 )。
*3 Aß アミロイド血漿バイオマーカー ...
免疫沈降-質量分析(IP-MS)法により測定されるAPP669-711/Aβ1-42 比とAβ1-40/Aβ1-42 比を組み合わせた血漿Aβ
複合バイオマーカー。PET検査に基づく脳アミロイド蓄積レベルと高い相関を示す。
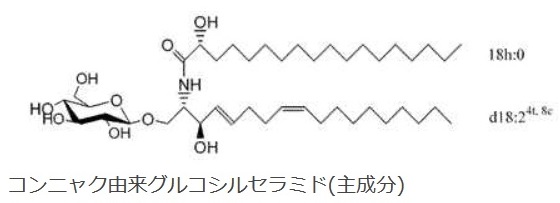
なお,本研究に用いたこんにゃく由来グルコシルセラミドは,皮膚の保湿・バリア機能を高める機能 性食品素材として販売している原料で,板こんにゃくの製造時に廃棄される「飛び粉」から抽出製造す るサステナブルな原料 です。また,グルコシルセラミドは,多くの植物に含まれていますが,小麦胚芽や米ぬかなどに比べ,こんにゃく芋の飛び粉抽出物はセラミド含有量が高いことがわかっています。
長良サイエンスの広告から:
グルコシルセラミド(Glucosylceramide)は,グルコースにセラミドが結合したスフィンゴ糖脂質の一種です。植物性グルコシルセラミドは保湿効果や抗アトピー効果のある素材として注目されるだけでなく,最近では抗腫瘍効果が報告され,その機能性が期待されています。
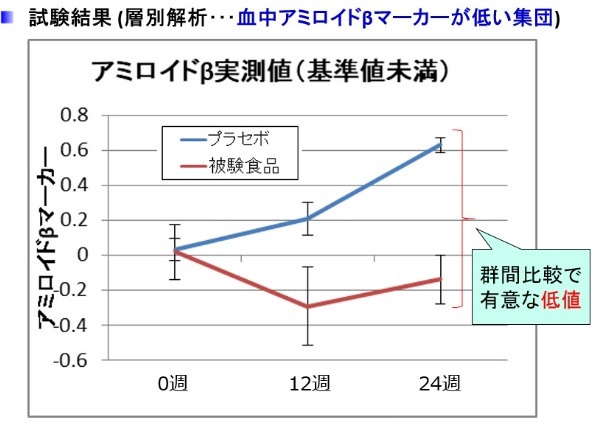
【研究成果】
被験食品群において, 0
週目 ( 摂取前 ) との比較で 12
週目に有意な低値を示しました。さらに層別解析 を行ったところ,摂取前の段階で血漿アミロイドβバイオマーカー値が相対的に低めの集団においては, 摂取
12
週後, 24
週後において被験食品群の変化量がプラセボ食品群より有意に低値を示しました ( 図 2) 。今回の結果は,植物グルコシルセラミドの持続的な摂取で脳内
Aß
蓄積が軽減できる可能性を示し ており,さらに Aß
アミロイド蓄積の初期段階に対して効果が高いことが示唆されました。
【今後への期待】
脳内
Aß
蓄積の抑制は
AD
予防の有効な戦略とされており,本研究で得られた新たな知見は機能性食 品素材や新薬開発に繋がる可能性があります。今後研究グループでは,ヒト介入試験をさらに進め,認 知機能分野における機能性素材の開発を推進します。
バイエル社 日本の循環器領域ポートフォリオをCytokinetics社のaficamtenにより強化
米国Cytokinetics社とaficamtenの日本における開発・商業化に関する独占的ライセンス契約を締結
最もよく見られる単一遺伝子循環器疾患である肥大型心筋症に伴う収縮亢進を軽減するようデザインされたaficamten Cytokinetics社は契約一時金および近い将来の後払い一時金約7,000万ユーロを受領し、売上に応じたロイヤルティとともに販売マイルストーン達成に応じて最大4億9,000万ユーロの商業化マイルストーンを受領
バイエル社の循環器領域の事業基盤強化戦略に合致
バイエル薬品は、バイエル社と循環器領域の後期開発品を手掛けるバイオ製薬企業である米国Cytokinetics社(Nasdaq:CYTK)が、日本におけるaficamten の開発および商業化に関する独占的提携およびライセンス契約を締結したことを本日発表しました。本提携契約は、日本人患者を含む一部の国際共同臨床試験はCytokinetics社が実施することを前提としています。aficamtenは、閉塞性・非閉塞性肥大型心筋症患者に対する治療薬候補の心筋ミオシン阻害剤 です。
本提携契約は、Cytokinetics社が有するaficamtenの広範な臨床開発プログラムと、アンメットメディカルニーズのある専門性の高い心疾患に対するバイエル薬品の日本における開発・商業化に関する知見と専門性を活用し、日本の患者さんに貢献することを目的としています。
aficamtenの共同開発計画に基づき、バイエル薬品は閉塞性肥大型心筋症の日本人患者を対象とした第Ⅲ相臨床試験を実施します。一方、Cytokinetics社は、非閉塞性肥大型心筋症患者を対象に実施中の国際共同第Ⅲ相臨床試験ACACIA-HCM、および閉塞性肥大型心筋症の小児患者を対象に実施中の臨床試験CEDAR-HCMを日本に拡大し、日本でバイエル薬品によるaficamtenの承認取得を支援する予定です。
aficamtenは、米国食品医薬品局(FDA)および中国国家食品薬品監督管理局(NMPA)より今年初めに、症候性閉塞性肥大型心筋症の治療薬として画期的治療薬指定(Breakthrough
Therapy Designation)を受けました。
バイエル薬品代表取締役社長のイン・チェンは次のように述べています。「これまでの研究開発で明らかになったaficamtenの可能性に大変期待しており、この治療薬を日本の患者さんに一日でも早くお届けしたいと考えています。今回の提携によりバイエル薬品は、バイエルグループが培ってきた創薬、薬事、商業化、ライフサイクルマネジメントに関する幅広い専門知識を活用し、日本における循環器領域への長年にわたるコミットメントをさらに強化していきます。当社はCytokinetics社との連携を通し、アンメットメディカルニーズの高い循環器疾患の患者さんに画期的な治療法をお届けするという使命を果たし続けていきます」
Cytokinetics社社長兼最高経営責任者のロバート・I・ブルーム氏は次のように述べています。「米国および欧州におけるaficamtenの商業化を実現するにあたり、バイエルグループの循環器領域における取り組みと専門知識を活用し、より多くの肥大型心筋症の患者さんにaficamtenを届けることができる可能性を広げる提携契約を同社と締結できることをうれしく思います。この日本に関する重要な取引は、当社の革新的な科学技術への潜在的アクセスを拡大するための豊富なコラボレーションの歴史に続くものです」
Cytokinetics社は本提携契約に基づき、契約一時金として5,000万ユーロを受領し、さらに発売後のマイルストーン達成に応じて最大9,000万ユーロ(うち2,000万ユーロは近い将来の後払い一時金)を受領する資格を有します。また、バイエル社が特定の売上マイルストーンを達成した場合には、最大4億9,000万ユーロの商業化マイルストーンを、さらに日本におけるaficamtenの売上に応じた段階的ロイヤルティを受け取ります。
aficamtenは、低分子化合物として開発中の選択的心筋ミオシン阻害剤
心筋ミオシンは、
心臓の収縮を担うタンパク質 aficamtenは 肥大型心筋症に関連する心筋の収縮亢進を軽減
aficamtenの臨床開発プログラムでは、肥大型心筋症患者の運動耐容能を改善し、症状を緩和する治療薬としての可能性と、心臓の構造と機能に対する長期的効果の可能性を評価しています。aficamtenは、症候性閉塞性肥大型心筋症患者を対象とした第Ⅲ相臨床試験SEQUOIA-HCM(Safety,
Efficacy, and Quantitative Understanding of Obstruction Impact
of Aficamten in HCM)で検討されました。aficamtenは、米国FDAおよび中国NMPAより症候性閉塞性肥大型心筋症の治療薬として、画期的治療薬指定を受けました。Cytokinetics社は、2024年第3四半期にFDAへaficamtenを新薬承認申請しており、2024年第4四半期には欧州医薬品庁(EMA)へ販売承認申請を行う予定です。
肥大型心筋症 は、心筋が異常に厚くなる(肥大する)病気です。心筋が肥大すると、左心室の内腔が小さく硬くなり、左心室が弛緩して血液を充満する能力が低下します。これにより最終的に心臓のポンプ機能が制限され、運動耐容能の低下や、運動中の胸痛、めまい、息切れ、失神などの症状が現れます。閉塞性肥大型心筋症は心筋の肥厚により左室流出路が閉塞している一方、非閉塞性肥大型心筋症は血流には影響がないものの、心筋が肥厚しています。肥大型心筋症は最もよく見られる単一遺伝子循環器疾患です。肥大型心筋症は、日本では難病指定されています。難病認定を受けた患者さんを対象とする2021年度の医療受給者証所持者数は4,201人とされていますが、心エコー検査によるスクリーニングでは、一般人口の500人から1,000人に1人に認められるとの報告もあります1 。2 。肥大型心筋症患者は、致死性心室不整脈の発症リスクがあり、若年者やスポーツ選手の突然死の主な原因の一つとなっています3 。肥大型心筋症患者の一部は、拡張型心筋症や心不全へと進行し、心臓移植が必要となるリスクが高くなります。