日本経済新聞 2005/10/4
富士写が医療関連拡大 治験支援大手シミックと新会社
富士写真フイルムは臨床試験(治験)支援大手のシミックと提携し、ライフサイエンス(生命科学)事業を拡大する。共同で新会社を設立、シミックが持つ医薬品の治験ノウハウを生かし、医療機関向けの製品を本格販売する。治験が必要な試薬開発も進める見通し。富士写は写真フィルムで培った製造技術が活用できると見て、医療・健康関連の機器やサービスを提供する「ライフサイエンス事業」を成長事業に育てる方針だ。
新会社は「富士フイルム・シミックヘルスケア」で資本金は1億円。富士写が6割、シミックが4割出資した。シミックが持つ医薬品の治験ノウハウを富士写の新製品開発に生かす。医療・健康関連市場の調査も共同で進める。
富士写はこれまで血液から遺伝子のDNA(デオキシリボ核酸)を高速抽出するシステムなどを開発、大学や企業に販売してきた。今後は病院向けに医療・健康関連機器・サービスを本格展開するのに加え、臨床試験の現場で使う試薬開発も進める方針で、治験作業が欠かせないと判断した。
富士写は新規事業創出の一環として、今年4月にライフサイエンス事業部を設立、事業拡大策を検討してきた。2005年度のライフサイエンス部門の連結売上高は約100億円の見込み。医療機関向けの製品・サービス販売の拡大をテコに、14年度をめどに約1千億円に引き上げる方針だ。
シミックは製薬会社が新薬開発で実施する臨床試験の受託大手。三共の開発責任者として大ヒット商品の高脂血症治療薬「メバロチン」を生み出した中村和男会長兼社長が1992年に事業を始めた。97年に日本で治験業務の一部外注が認められたことを機に急成長し、創薬事業にも参入した。
日本経済新聞 2005/10/7
三菱重工 コニカミノルタと提携 医療機器で共同出資会社
三菱重工業は医療機器事業でコニカミノルタホールディングスと提携する。共同出資会社を設立し、三菱重工が開発したX線がん治療装置を販売するほか、コニカミノルタの診断装置技術を取り入れた新製品の共同開発にも乗り出す。提携を機に医療機器事業を新たな柱に育てる。
共同出資会社、MHIメディカルシステムズは資本金9600万円。三菱重工が50%、コニカミノルタの医療機器子会社であるコニカミノルタエムジーが20%、三菱商事、西華産業がそれぞれ15%出資し、11日に設立する。
三菱重工はすでにX線がん治療装置の製造販売承認を厚生労働省に申請しており、承認され次第、販売を始める。三菱重工は医療機器で実績のあるコニカミノルタの販売ルートを活用して新事業を軌道に乗せるのが狙い。一方、コニカミノルタは販売品目を広げることで医療機器事業の拡大を目指す。
将来はコニカミノルタが持つデジタル画像撮影技術などと三菱重工の位置決め技術や放射線技術などを融合した新製品の共同開発に乗り出す考え。
X線がん治療装置では国内首位だった三菱電機が撤退を決めており、世界では独シーメンス、米バリアンメディカルシステムズ、英エレクタの寡占状態になっている。
三菱重工は印刷機械の位置決め技術などを活用してX線の照射精度を高める次世代の装置開発にも着手しており、将来は精度の高さで欧米3社に対抗していく方針。今後はX線以外の治療装置開発にも乗り出し、医療機器事業を主力事業の一つに育てる考え。
2005年10月7日 三菱重工
放射線治療装置などの販売・サービス会社を設立
コニカミノルタエムジー、三菱商事、西華産業と合弁で
http://www.mhi-ir.jp/news/sec1/200510074402.html
三菱重工業は11日、放射線治療装置を主体とした医療機器の販売・サービス会社「MHIメディカルシステムズ株式会社(MHI
Medical Systems, Inc.)」を、コニカミノルタエムジー、三菱商事、西華産業と合弁で設立する。当社が開発を進めている、がん治療を目的とした放射線治療装置などを取り扱うもので、申請中の薬事法上の各種承認を取得次第、営業活動を開始する。
MHI
メディカルシステムズは、本社を東京都港区三田に置き、放射線治療装置をはじめとする医療機器の販売・保守・点検・修理サービスを手掛ける。資本金は
9,600万円で、各社の出資比率は当社50%、コニカミノルタエムジー20%、三菱商事15%、西華産業15%。経営陣・社員総勢11人の陣容でスタートし、今後、保守サービス要員などを順次増強していく。社長には当社で本装置開発プロジェクトに携わっていた石橋
明(現
菱明技研株式会社※機械プラント技術部主管)が就任する。
当社が医療機器ビジネスに参入するのは今回が初めて。そのため、この分野で豊富な経験を有する各社とともに事業展開をはかる。コニカミノルタエムジーは、医療用X線フィルムやCR(コンピューティッド・ラジオグラフィー)、レーザーイメージャーなど医療用診断分野での販売・保守サービス網を持ち、三菱商事は、病院経営支援など各種ソリューションの提供を通じた医療関連事業化のノウハウを有す。また、西華産業は、画像診断ソフトウェアや医療機器などの販売を通じ医療現場に精通している。各社はこれらを持ち寄って新会社の経営に参画する。
新事業の核となる放射線治療装置は2004年7月に当社が新たに導入した社内ベンチャープロジェクト制度の認定を受けて開発を推進しているもの。
新会社は、薬事法上の「製造販売承認」ならびに「製造販売業の許可」の取得を待って、放射線治療装置の販売・サービス事業を開始、国内はもちろん、広く海外の販路も開拓していく方針。また、放射線治療装置のほか、新たな医療機器の開発も検討していく。
※ 菱明技研株式会社
当社の技術本部の実験業務支援を目的に設立された当社全額出資関連会社。
本 社:広島市西区
取締役社長:塚本 頴彦
1.会社概要
(1) 商 号:MHIメディカルシステムズ株式会社
(英文名:MHI Medical Systems, Inc.)
(2)
事業内容:医療機器の販売、保守・点検・修理サービス
(3) 設立年月日:平成17年10月11日
(4) 本社所在地:東京都港区三田三丁目11番36号
(5) 代表者 :石橋 明
(6) 資本金 :96百万円
(出資比率 三菱重工業 50%、コニカミノルタエムジー
20%、三菱商事 15%、西華産業 15%)
(7) 人 員 :11人 (常/非常勤で、保守サービス対応要員を除く)
2.各社概要
◇ 三菱重工業株式会社
所 在 地:東京都港区港南2-16-5
取締役社長:佃 和夫
◇コニカミノルタエムジー株式会社
所 在 地:東京都新宿区西新宿1-26-2 新宿野村ビル
取締役社長:谷田 清文
◇三菱商事株式会社
所 在 地:東京都千代田区丸の内2-6-3
代表取締役社長:小島 順彦
◇西華産業株式会社
所 在 地: 東京都千代田区丸の内3-3-1
新東京ビル
取締役社長: 藤本 守孝
日本経済新聞 2005/10/19
バイオベンチャー新タイプ 創薬基盤技術型が台頭
高い技術力 独自医薬品候補も保有 製薬会社支援実績重ねる
日本のバイオベンチャーで新しいタイプの企業群が台頭している。完成間近の医薬品は持っていないが、創薬に直結する技術を持つ「創薬基盤技術型」だ。これまでは医薬品を開発する「創薬型」と解析機器などを販売する「研究支援型」か中心だった。中間型ともいえる企業群は製薬会社との取引実績を積み重ね、バイオ市場の成長を引っ張る可能性がある。
「ようやく製薬会社からの評価が変わってきた」。たんぱく質解析を手がけるメヂィカル・プロテオスコープ(MPS)の松山哲人社長ば自信を深める。
きっかけは欧州のアストラゼネカと抗がん剤「イレツサ」の副作用の原因となるマーカー探索などで共同研究契約を結んだことだ。一気に風向きが変わり、大鵬薬品工業や東レとも共同研究の契約締結に成功した。
創薬基盤技術型の台頭はMPSだけではない。たんぱく質の立体構造を解析し、病気の発現を抑える化合物を効率よく探し出す技術を持つファルマデザインは、杏林製薬など3社と共同研究にこぎつけた。ナノキャリア(千葉県柏市)は医薬品の効果を高め副作用も抑える独自の薬物送達技術を武器に日本化薬やキリンビールなど4社と抗がん剤など医薬品開発を進める。
日本のバイオベンチャーは従来、創薬型と研究支援型の二つが主流。創薬型は自社で発見した医薬品候補などを製品化し、他の製薬会社などに開発権や販売権などを供与する。当初は赤字が膨らむが、製品化に成功すれば、利益は大きく膨らむ事業モデルだ。株式市場での時価総額は代表的存在のアンジェスMGで800億円に達する。
一方、研究支援型は医薬品を開発せず、研究機関を中心に機器や解析サービスを提供する。安定収益が見込めるが、大きな成長は難しい。時価総額も100億円以下にとどまる企業が多い。
中間に位置する創薬基盤技術型は創薬に直結する技術で、製薬会社を支援する。さらに自らが発見した医薬品候補も持っており、創薬につながる可能性も持つ。ただ保有する医薬品候補は基礎研究の段階が多く、製薬会社に開発権や販売権を供与した実績はない。
いちよし経済研究所の山崎清一首席研究員は「日本でも創薬型でも研究支援型でもない、第三の評価軸があってもおかしくない」と話す。
長い開発期間と先行投資が必要なバイオベンチャーにとって資本市場からの資金調達は不可欠だ。これまでならMPSは上場しても研究支援型並西の評価しか得られなかったとみられるが、創薬基盤技術型としての評価が認められればより多くの資金を調達できる。米国では昨年5月にナスダックに上場したアルナイラム社の時価総額は200億円を超える。
実績を積み重ねている日本の創薬基盤技術型も評価される環境がようやく整ってきた。
日本経済新聞 2005/10/21
韓国、ES細胞を世界に提供
再生医療 本命見えず クローン技術使わぬ方法も
韓国政府が19日、クローン技術で作ったヒトの「胚性幹細胞(ES細胞)」を世界に提供する計画を明らかにした。あらゆる組織や臓器の細胞になり、しかも移植時に拒絶反応が出ないといわれる。将来の再生医療の有力技術。しかし再生医療技術は様々な手法があり、どれが本命なのか研究者の間で見方が分かれている。
クローン技術を使わないが、免疫拒絶反応は起きない。こんな「新万能細胞」の開発を急ぐのはバイオベンチャーのリプ
ロセル(桑名隆滋社長)。ES細胞と患者の血球や皮膚の細胞を融合して作る。マウスの細胞で基礎技術を確立済みだ。新万能細胞なら新たな卵子が不要で、患者の細胞だけで済む。技術的に作りやすい。似たアイデアの研究は米国でも進む。実用段階になったら普及する可能性がある。
韓国で作製されたヒトクローンES細胞を作るには、患者一人に対して女性から提供してもらう卵子が一つ必要で、生命倫理面の課題も抱える。しかも「ヒトのクローンES細胞を作るのはそう簡単ではない。(多くの患者を対象にした)一般治療には使えない」(理化学研究所発生・再生科学総合研究センターの笹井芳樹グループディレクター)という声も出ている。
一方、ES細胞とは異なり、患者の体内のあちこちにある「幹細胞」を取り出し、臓器や組織を修復する臨床試験も国内外で始まっている。
国立循環器病センターは患者の骨髄の「間葉系幹細胞」を心臓に注射し、心筋や血管を作り出す臨床試験を手がけている。骨髄幹細胞や足の太ももの筋肉細胞で心臓を修復する試験も大阪大学で進む。
患者本人の細胞を使うので拒絶反応の心配もない。卵子や受精卵を使うという生命倫理面の課題も絡まない。
ただ、ヒトクローンES細胞で韓国に先行されたことが痛手であることは確か。京都大学再生医科学研究所の中辻憲夫所長は「拒絶反応抑制が話題になりがちだが、むしろ原因遺伝子が分からない難病患者の臓器を(試験的に)作製して研究できる点が大きい」と指摘する。慶応義塾大学の岡野栄之教授も「ヒトクローンES細胞は病気の原因解明などにも有用」と強調する。
韓国や米国、英国も当面は、再生医療への実用化というより基礎研究分野にあるといわれる。文部科学省の専門部会は、ヒトクローンES細胞の研究指針を策定中。韓国の動きを受け、今後指針の内容をどうするのか注目される。
国内の主な再生医療研究
| 材料となる細胞 | 手がけている主な機関 | 作製する細胞 | 開発段階 |
| ヒトES細胞 | 京都大学・田辺製薬 | 血管 | ヒト細胞で基礎研究 |
| 慶応大学 | 神経 | 〃 | |
| 理化学研究所 | 神経 | 〃 | |
| 東京大学 | 造血細胞 | 〃 | |
| 患者細胞と融合したES細胞 | リプロセル | 骨、神経、血管など | 動物細胞で基礎研究 |
| 患者の脂肪にある幹細胞 | 名古屋大・協和発酵 | 脂肪、骨 | ヒト細胞で基礎研究 |
| 患者の骨髄にある幹細胞 | 国立循環器病センター | 血管、心筋 | 臨床研究 |
| 大阪大学 | 血管、心筋 | 〃 | |
| 信州大学 | 血管 | 〃 | |
| 埼玉医科大学 | 血管 | 〃 |
日本経済新聞 2005/10/21
後発医薬品追い風期待 医療制度改革、普及促す
東和薬品 営業担当400人に
日本調剤 薬局自ら開発も
特許切れ成分を使う低価格の後発医薬品市場の拡大をにらみ、専業メーカーと調剤薬局が販売体制の拡充や研究開発の強化に乗り出している。大手病院の採用が広がりつつあるのに加え、医療費削減を急ぐ厚生労働省も19日発表した医療制度改革試案で後発医薬品の普及を後押しする。各社は製品の信頼性や効率を高め、病院や薬局への売り込みに拍車をかける。
後発薬専業メーカーの東和薬品や富士製薬工業は、医薬情報担当者(MR)を増強し、病院向けの営業体制を拡充する。東和は現在、約350人いるMRを2006年度中に400人に増やす計画。富士製薬は10月に「基幹病院担当チーム」を新設し13人の病院専門のMRを配置。コスト意識の高い大手病院を中心に営業攻勢をかける。
沢井製薬は研究体制を強化。90人の研究者を08年3月までに150人に増やす。3カ所の研究拠点は来秋をめどに大
阪府内の1カ所に集約し開発の効率を高める。
調剤薬局チェーン大手の日本調剤は自ら開発に乗り出す。1月に設立した子会社の日本ジェネリックで、10月から東京都内の研究施設で先発医薬品との比較など臨床開発の準備を始めた。30人体制で副作用の有無などを調べる。患者の購買データを生かし、生活習慣病の治療薬を中心に2年後の製品化をめざす。
後発薬については従来、医師の間に「信頼性が低い」との声もあった。だが04年時点で国内市場は約4千億円まで増加、現在では医療用医薬品の1割近く(金額べース)まで拡大しているとの見方もある。
後発薬の薬価ば新薬の7分の1から8分の1程度まで下がることもあり、患者が後発薬に切り替えると自己負担が軽くなる場合が多い。このため厚労省は患者の医療コスト削減の狙いから後発薬の信頼性や使いやすさを高める政策を打ち出している。国立病院や大学病院などが採用する事例も増えている。
また、今年以降、国内外の大型製品が相次ぎ特許切れを迎える。後発薬メーカーにとって、大手が開拓した有望市場への参入機会が拡大することも、各社の販売・開発体制強化の背景にある。
▼後発(ジェネリック)医薬品
製薬会社が新規に開発する医療用医薬品を「新薬」と呼び、これと成分や用法などが同じ医薬品を指す。新薬の特許期間などが過ぎれば発売可能になるため、複数のメーカーがほぼ同時期に売り出す場合が多い。医薬品の公定価格である薬価を決める場合、後発医薬品は新薬より30%低い金額に設定される。すでに他の後発薬がある場合は、その中の最低価格に決まり、年を追うごとに価格は下がる。
市場成長でも競合激化 再編・淘汰避けられず
国内の後発医薬品メーカーは大手の東和薬品や沢井製薬でも年間売上高は200億円強で、薬界は中堅、中小メーカーが多数ひしめく。市場は年率10%弱の成長が続いているものの、今後も競合は激化するとみられ、淘汰、統合など再編は避けられない情勢だ。
後発薬のセールスポイントは、「低価格」。ただ、医薬品の生産や販売の品質維持に関して国が求める基準が厳しくなっているため投資負担は年々、増加している。
| 主な国内の後発薬メーカーの売上高 (単位億円、富士製薬工業のみ単独業績) |
||||||||
|
低コストと高品質の両立に向けて経営基盤の強化を迫られるなか、再編に活路を見いだす動きもある。専業メーカーの日医工は4月、規模のメリットによる収益力改善を狙い、同業のマルコ製薬(名古屋市)を傘下に収めた。一方、中堅製薬の杏林製薬が今年5月、後発医薬品の東洋ファルマー(金沢市)を子会社化したのは、「単独では生き残りが難しかった」(東洋ファルマー)との事情がある。
山之内製薬(現アステラス製薬)や大正製薬など、かつて後発薬に参入した新薬大手は相次ぎ撤退・休止した。厳しいコスト削減を強いられる消耗戦を避け、「研究開発型の新薬メーカーに特化する」(アステラス製薬)との経営判断からだ。
欧米ではすでに再編が急速に進んでいる。イスラエルの大手、テバ・ファーマシューティカル・インダストリーズが7月、米国の同業メーカーを74億ドルで買収。スイスのノバルティスも6月、ドイツの後発メーカーを買収して自社の後発医薬品部門と統合した。
ニュートリション事業部の分社化について
http://release.nikkei.co.jp/detail.cfm?relID=114234&lindID=4
ノバルティスは、2006年1月1日付でニュートリション事業部を分離独立させ、ノバルティス ニュートリション株式会社を設立します。
日本におけるノバルティスのニュートリション事業部は、ノバルティス社(本社:スイス・バーゼル市)によるミードジョンソンの成人向け医療用栄養食品事業の買収に伴い、2004年2月14日付で設立されました。
現在、日本のニュートリション事業部はノバルティス ファーマ株式会社の一事業部となっており、今回の分社化はこの事業部を分離独立させるものです。分離後はノバルティスホールディングジャパン株式会社傘下の全額出資事業会社として、国内医療用栄養食品市場におけるポジションをより一層強化してまいります。
■ 新会社の概要
社名: ノバルティス ニュートリション株式会社(Novartis Nutrition K.K.)
(ノバルティスホールディングジャパン株式会社の100%子会社)
本社所在地: 東京都港区西麻布4丁目16-13 西麻布28森ビル
代表取締役社長: 志道 保(しじ たもつ)
社員数: 約100人
事業内容: 医療用栄養食品(医療機関・介護施設向け栄養食品)の製造・販売
主要製品:
アイソカル(R)・アルジネード(TM)、アイソカル(R)・RTU、アイソカル(R)・プラス、アイソカル(R)・2K、アイソカル(R)・プディング、アイソカル(R)・ジェリーPCF、アイソカル(R)・ジェリー“くりん”
■ アイソカル(R)シリーズについて
アイソカル(R)は、ノバルティス ファーマ株式会社ニュートリション事業部が扱う栄養補給食品シリーズのブランド名です。褥瘡栄養サポートのアイソカル(R)・アルジネード(TM)をはじめとするアイソカル(R)シリーズは、日本において15年以上にわたり、全国約8,000軒の医療機関や高齢者施設に提供されています。
■ ノバルティス医療用栄養食品事業について
ノバルティス医療用栄養食品事業は、ノバルティス コンシューマーヘルス部門の主要事業のひとつです。患者さんやヘルスケアの専門家のさまざまなニーズに応える、経腸・経口の医療用栄養食品と、関連医療器具を販売しています。栄養補給のための経口食品から、医療器具を使用して摂取する流動食、医療器具まで、全世界で幅広く取り扱っています。
■ ノバルティスについて
ノバルティスは、医薬品とコンシューマーヘルスにおける世界的リーダーです。ノバルティス グループ全体の2004年の売上高は282億米ドル(約3兆507億円)で、当期純利益は56億米ドル(約6,049億円)*、研究開発費は41億米ドル(約4,403億円)*でした。スイス・バーゼル市に本拠を置くノバルティスは、約91,700人の社員を擁しており、世界140カ国以上で製品が販売されています。詳細はインターネットをご覧下さい。
スイス本社⇒ http://www.novartis.com 日本法人⇒ http://www.novartis.co.jp
*2005年の会計基準ベース
2005/10/31 メルク
ドイツメルク
日本における医薬品事業の再編を発表
http://release.nikkei.co.jp/detail.cfm?relID=114620&lindID=4
メルク株式会社(本社東京、社長 クラウス・ディール)及びメルク・ホエイ株式会社(本社大阪、社長 同)の親会社であるMerk
KGaA(本社ドイツ ダルムシュタット市、社長 ベルンハルト・ショイブレ)は10月31日、日本における医薬品事業の再編計画を発表しました。2006年4月にメルク株式会社の医薬品事業部とジェネリック医薬品の拠点であるメルク・ホエイ株式会社を統合し、新会社メルクファーマ株式会社(本社東京)を設立いたします。
この統合により世界第2の医薬品市場である日本でのメルクの基盤強化と、各部門での統合効果を期待しております。
メルク株式会社社長兼メルク・ホエイ株式会社社長のクラウス・ディールは「これまで別々であった医療用医薬品事業とジェネリック医薬品事業を統合することにより、メルクは日本における医薬品事業においてより重要な役割を担うこととなる。」と述べています。
メルク・ホエイ株式会社は1950年に保栄薬工として発足し、1998年にメルク・グループの傘下に入った後、日本におけるメルク・グループのジェネリック医薬品事業を担ってきました。メルク株式会社との統合により、管理部門における統合効果も期待されます。メルク・ホエイ株式会社前社長浅野克彦氏は10月31日付で退任いたしました。2006年4月発足のメルクファーマ株式会社の代表取締役会長兼社長にはメルク株式会社代表取締役社長のクラウス・ディールが就任いたします。同氏はメルク株式会社、メルクファーマ株式会社両社の代表取締役を兼務いたします。又、10月31日付で佐藤公明がメルク・ホエイ株式会社に入社し常務取締役に就任いたしました。同氏はメルクファーマ株式会社でジェネリック医薬品部門の責任者に就任いたします。現メルク株式会社医薬品事業部長のクラウス・ヘーネッケネーベルは引き続きメルクファーマ株式会社においても医療用医薬品部門の責任者に就任いたします。
メルク株式会社の2004年12月期の売上げは527億円、新会社発足後同社は液晶事業、顔料事業を中心とした化成品事業3分野に特化することとなります。
メルク株式会社はドイツのダルムシュタットに本社を置く、世界的な総合医化学メーカー Merck KGaAの日本法人であり、1968年に設立、液晶や顔料などの化成品や試薬・分析薬、医薬品等を手がけています。又、Merck KGaAは1668年に設立され、現在世界54カ国で事業展開を行っており、グループ従業員総数は28,800人。2004年売上高は約59億ユーロ。
2005/11/25 カネボウ株式会社
中国における販売会社の設立について
http://www.kanebo.co.jp/files/051125_01/051125yakuhin.pdf
当社は、中国における保健食品(日本の特定保健用食品に相当)、医薬品、漢方薬のエキス粉末等の販売会社の設立に関して、中国医薬集団総公司傘下の中国薬材集団公司及び中国医薬対外貿易公司と合意に達し、本日(11
月25 日)、中国北京市にて3社による調印式を行いましたので、お知らせいたします。
新販売会社は、2006 年3
月に中国で設立登記され、同年秋より中国や欧米の市場に向け、本格的な販売を開始する予定です。
近年、世界的な病気予防や健康志向の高まりから、漢方薬を含む植物を素材とする製品市場は拡大しており、約2
兆円超に達していると言われています。一方、中国では近年、西洋薬が急速に普及されるなか、第十次5
ヵ年計画では中成薬の現代化が国家重点政策になっており、現在では年率20%前後で急成長しています。
当社は、中国青島市にある合弁企業「青島華鐘製薬有限公司
」(出資比率:当社50%、中国薬材集団公司25%、中国医薬対外貿易公司10%、青島国風集団薬材有限責任公司15%)
で、漢方薬のエキス粉末等の中間体を日本向けに製造しており、これまで中国は原料供給拠点としての位置づけでありました。今後、中国及び世界の薬用植物由来製品市場の成長が益々期待される状況下、原料供給に加え、流通や販売拠点として中国市場を捉え、現地パートナーとの協議を通し、このたび新会社の設立の合意に至りました。
新会社の役員は9 名を予定しており、当社から6
名、中国側から3
名が派遣されます。董事長として張洪亮氏(ZHANG
HONGLIANG 中国医薬集団総公司の副董事長)、副董事長として水野陽介(当社執行役薬品事業本部長)が就任予定であり、総経理は当社から派遣が予定されております。
<新会社の概要及び事業内容>
1.社 名 「華鐘高科医薬(北京)有限公司」
2.設立時期 2006 年3 月(予定)
3.所在地 中国北京市
4.資本金 100 万米ドル
出資構成:カネボウ株式会社65%、中国薬材集団公司25%、中国医薬対外貿易公司10%
5.事業内容
保健食品、医薬品、漢方エキス粉末並びに関連製品の販売、輸出入及びこれら製品に関する
コンサルティングサービスの提供その他関連業務。
<参考>
1.中国医薬集団総公司の概要
①設立時期 1998 年
②所在地 北京市海淀区知春路20 号
③董事長 鄭鴻
④事業内容
中国中央政府が管理する医薬研究、生産、サービス貿易
2.中国薬材集団公司の概要
①設立時期 1955 年
②所在地 北京市宣武区広安門外大街248 号
③総経理 李光甫
④事業内容
生薬、エキス、漢方薬の研究開発、製造・販売
3.中国医薬対外貿易公司の概要
①設立時期 1981 年
②所在地 北京市海淀区知春路20 号
③総経理 厳兵
④事業内容 医薬関連製品の輸出入
4.青島華鐘製薬有限公司の概要
①設立時期 1988 年
②資本金 10 億円
③所在地 山東省青島市重慶南路202 号
④総経理 加藤嘉昭
⑤事業内容 各種漢方薬の製造・販売
日本経済新聞 2006/1/24 沢井製薬発表
住商 沢井製薬子会社に出資
住友商事は23日、沢井製薬の全額出資子会社、メディサ新薬に資本参加すると発表した。1月末に実施する第三者割当増資を引き受け、住商グループで35%を出資する。特許切れ成分を使う後発医薬品を取り扱うメディサ新薬に対し、海外メーカーの技術仲介や販売ルート開拓で支援する。
住商が20%、住商子会社の住商メディケムが15%を出資する。出資額は両社合わせて12億2700万円。役員も派遣する。メディサ新薬は自前の販売ルートを持たず、新薬メーカーなどに販売している。
2006/1/23 沢井製薬
沢井製薬株式会社
子会社「メディサ新薬株式会社」による、
住友商事グループを割当先とする第三者割当増資実施のお知らせ
http://www.sawai.co.jp/press/2006/20060123.html
沢井製薬株式会社の連結子会社であるメディサ新薬株式会社におきまして、住友商事株式会社および住商メディケム株式会社を引き受け先とする第三者割当増資を実施することについて、沢井製薬株式会社、メディサ新薬株式会社、住友商事株式会社および住商メディケム株式会社の4社間におきまして基本合意に至りましたので、下記のとおりお知らせいたします。
* 1.目的
メディサ新薬株式会社は昭和60年の設立以来、沢井製薬株式会社の100%子会社としてジェネリック医薬品を開発・製造し、沢井製薬株式会社の他、新薬メーカーへもジェネリック医薬品を販売いたしております。医療費の節減と患者の自己負担軽減のため、経済的なジェネリック医薬品の使用を促進することは、国の医療費抑制方針とも合致致します。特に薬価が高く長期の治療で薬剤費負担が高額となるがん患者の場合、抗がん剤のジェネリック医薬品のニーズは高く、メディサ新薬株式会社では、抗がん剤に特化した開発と品揃えを、新たに積極的に手掛ける事を決定致しました。
その為、国内および海外の豊富なネットワークを持つ会社と提携し、候補医薬品の導入・開発等を推進・加速する必要があると判断致しました。
住友商事株式会社及び同社100%子会社で医薬分野に特化した住商メディケム株式会社は、国内外の製薬企業との関係も深い上、医療ビジネスのシーズを数多く保有し、製薬事業への進出に積極的に取組んでおり、抗がん剤のジェネリック医薬品事業に着目しておりました。
今般の住友商事株式会社および住商メディケム株式会社への第三者割当増資によるメディサ新薬株式会社への資本参加により、メディサ新薬株式会社の既存事業の拡充および新規抗がん剤ジェネリック医薬品開発事業の円滑な立ち上げを目指して参ります。
*
2.メディサ新薬株式会社における第三者割当増資の概要
(1)発行株式 普通株式 3,230株
(2)発行価額総額 12億2,740万円
(3)払込期日 平成18年1月31日(予定)
(4)増資後の株主構成 沢井製薬株式会社 約65%
住友商事株式会社 約20%
住商メディケム株式会社 約15%
* 3.メディサ新薬株式会社の概要(平成17年3月31日現在)
①商号 メディサ新薬株式会社
②代表者 代表取締役社長 岩佐 孝
③本社所在地 東京都中央区日本橋本町4-15-19
④主な事業内容
医療用医薬品(ジェネリック医薬品)の製造販売
消化器官・循環器官用薬など医療用医薬品110品目
⑤設立 昭和60年3月
⑥決算期 3月31日
⑦従業員数 90名
⑧資本金 300百万円
⑨発行済株式数 6,000株
⑩株主構成 沢井製薬株式会社 100%
* 4.住商メディケム株式会社の概要(平成17年9月30日現在)
①商号 住商メディケム株式会社
②代表者 代表取締役社長 木村 榮
③本社所在地 東京都中央区晴海1-8-12
④主な事業内容
医薬品原体、賦形剤、中間体、反応助剤、食品添加物の販売
⑤設立 昭和49年11月
⑥決算期 3月31日
⑦従業員数 31名
⑧資本金 138百万円
⑨発行済株式数 1,400,000株
⑩株主構成 住友商事株式会社 100%
* 5.業績への影響
本件による、沢井製薬株式会社および住友商事株式会社における平成18年3月期業績への影響はありません。
2006年1月24日 エーザイ
英国に欧州戦略拠点を設立
http://www.eisai.co.jp/news/news200603.html
エーザイ株式会社(本社:東京都、社長:内藤晴夫)の欧州統括子会社であるエーザイ・ヨーロッパ・リミテッド(本社:ロンドン、社長:土屋裕)は、このたび英国アーリントン社と欧州戦略拠点設立に向けた土地売買ならびに開発に関する覚書を締結いたしました。今後エーザイは、本用地に欧州における研究、臨床開発、生産、販売、欧州統括の各機能を集約し、欧州全域にわたる事業活動の中心となる戦略拠点を構築してまいります。
今回覚書を締結した用地は、ロンドン北部に位置するHatfield
Business Park内の約14.6エーカー(約1.8万坪)の区画であり、用地内に新たに工場を有する生産子会社を設立します。2006年より建設を開始し、順次、既存の欧州統括子会社エーザイ・ヨーロッパ・リミテッド、臨床研究・販売子会社エーザイ・リミテッドを移転し、さらにロンドン大学(UCL)内の探索研究子会社エーザイ・ロンドン・リサーチ・ラボラトリーズ・リミテッドを拡張・強化するための探索研究機能も付加して、2008年には本拠点で、初回生産および創薬研究活動を開始します。土地購入費用を含めた総投資額は、約150億円を想定しています。また、本拠点の構築は、Hatfield
Business Park内に、300名の新たな雇用を含む総勢500名以上の雇用をもたらすことになります。
当社は、欧州地域を医薬品市場の成長可能性が高く、先進の科学技術や臨床開発の仕組みを備えた非常に重要な地域と考えています。なかでも英国は、生命科学分野における革新的な発明の歴史があり、製薬産業の集積地であることから、戦略拠点構築に最適な場所であると判断しました。当社は、1990年に設立したロンドン大学(UCL)内の探索研究子会社で、すでにパーキンソン病、てんかん、多発性硬化症などの神経変性疾患の治療剤として開発中の新規化合物を見出しています。英国の医薬・バイオ産業の集積地である本地域で、新たな戦略拠点を設置することにより、さらなるブレークスルーにつながる発見を期待しています。
当社は、企業理念を定款に記載し、その中で当社の使命は患者様価値の増大であり、これを実現するにあたっては、未だ満たされていない医療ニーズの充足、高品質製品の安定供給、薬剤の安全性と有効性を含む有用性情報の伝達に努めると明記しております。今回の欧州戦略拠点の構築により、当社は世界の3大医薬品市場である米国、欧州、日本において、研究開発から生産、販売、医薬品の安全性情報の管理・提供までの各機能が密接に連携し、患者様満足の増大をはかるためのシームレス・バリュー・チェーンを構築することになります。当社はこれにより、さらなる効率性と生産性、品質の向上をはかってまいります。
当社は、すでに欧州主要地域において英国、ドイツ、フランス、スペイン、イタリア、スイス、スウェーデンに医薬品販売子会社を設立し、自社医薬品販売体制の充実をはかっています。今後はさらに欧州全域を俯瞰した事業展開を加速させ、欧州地域における患者様満足の増大をはかり、より多くの患者様のベネフィット向上に貢献してまいります。
英国貿易投資総省 ファクトシート 2006年1月
参考資料 英国の医薬品・バイオテクノロジー産業の概要
英国のバイオテクノロジー産業は欧州で最大の規模を誇り、450社を超える製薬企業が研究や製造の拠点を英国に置いています。2003年には、これらの企業によって開発された224種の新薬が後期臨床試験段階にあり、欧州全体の40%を占めるに至っています。また、2003年には、63億ドルに上る研究開発への投資が行われるなど、英国が米国や日本と並び世界トップスリーに入る優れた研究開発拠点であることが伺えます。
・医薬品・バイオテクノロジー産業を支える産官学の連携
英国の医薬品・バイオテクノロジー産業の成功を支える基礎には、世界屈指の研究機関や、スピン・オフ企業が持つ数々の優れた基礎研究・技術を活かす産官学の連携があります。世界トップの製薬会社12社が英国に研究開発や製造拠点を構えています。また、ロンドンにはEMEA
(欧州医薬品審査庁)の本部や、欧州内の特許申請を扱う英国特許局の支部が置かれており、製薬会社にとって様々な医療関連情報の入手や申請に好都合な環境となっています。また、英国政府はバイオテクノロジー関連の研究に年約9億6,000万ドルの予算を計上し、産業や研究開発を抑圧せず、安全性や環境保全を維持できるような規制や対策を実施しています。このように医薬品・バイオテクノロジー産業の発展を目指した支援体制を強化してきた結果、2004年度には、世界的にバイオ・医薬関連産業の成長が停滞したにもかかわらず、医薬品売上高では10%の成長が見られました。
・医薬品・バイオテクノロジー産業の主な特徴
‐
欧州にある株式公開バイオテクノロジー企業の約半数が英国に拠点を持っている
‐ 欧州における臨床試験中の新薬候補の40%は英国企業による
‐ 世界で売れているベスト100 の医薬品の内、約4分の1は英国で開発された
‐ 約73,000人が直接雇用されており、その内3分の1がR&Dに、22,400人がバイオテクノロジー関連に従事している
英国への直接投資の概要
英国政府は、長期雇用を保証し、新しいテクノロジーやマネジメント手法を導入することにより、今後英国のビジネス環境をより競争力の高いものとしていく対英投資プロジェクトに強い関心を持って取り組んできました。柔軟な規制や優遇税制措置、研究開発の奨励、産学協同の基盤整備など、政府の積極的な政策や活動により、2004/05年度の対英投資件数は過去最多の1066件(対前年比31%増)となり、新たに39,592人の雇用を創出しました。*1
また、日本からの対英投資は、これまで100,000人以上の雇用を創出し、投資国のリーダー的な存在となっています。
*1 2005年7月に英国貿易投資総省が発表した2004~05年度の投資実績による
日本経済新聞 2006/2/19
世界医薬大手 咋年の売上高
欧州勢伸び米社苦戦 武田は順位下げ14位
世界の製薬大手の2005年決算がほぼ出そろい、売上高を順調に伸ばす欧州企業と、苦戦気味の米上位の明暗が浮き彫りになった。日本勢では武田薬品工業の14位が最高で、第一三共は16位、アステラス製薬は17位に食い込んだ。大型医薬品の販売動向や特許切れ対策で順位が入れ替わる構図になっている。
低調だったのは米ファイザーと米メルク。ファイザーは連続首位だが、売上高の4分の1を占める高脂血症治療薬「リピトール」の伸び率鈍化が目立つ。メルクは04年の4位から7位に転落。主力の高脂血症治療薬が低調だった。
欧州勢では、ぜんそくや糖尿病の治療薬が好調な英グラクソスミスクライン(GSK)が8%増で2位。主力抗うつ剤「パキシル」の特許切れを他製品で乗り越えた。
日本の武田薬品工業は糖尿病治療薬の好調などで、前年度比6%増の見通しだが、順位は米アムジェン(前年比20%増)に抜かれ14位。昨年、第一製薬と三共が経営統合して発足した第一三共、山之内製薬と藤沢薬品工業が統合したアステラス製薬は、統合で順位を上げた。
ランキングは医療用医薬品をべースに集計。一部の会社の売上高には大衆役の売上高を含む。
世界医薬大手の売上高ランキング
(カッコ内は2004年順位、▲マイナス)
| 順位 | 会社名(国名) | 売上高 (億ドル) |
伸率 (%) |
1(1) |
ファイザー(米) |
442.8 |
4 |
2(2) |
グラクソスミスクライン(英) |
339.6 |
8 |
3(3) |
サノフィ.アベンティス(仏) |
338.6 |
8 |
4(6) |
ノバルディス(スイス) |
249.6 |
16 |
5(7) |
アストラゼネカ(英) |
239.5 |
12 |
6(5) |
ジョンソン・エンド・ジョンソン(米) |
223.2 |
1 |
7(4) |
メルク(米) |
220.1 |
▲4 |
8(8) |
ロシュ(スイス) |
215.7 |
26 |
9(10) |
ワイス(米) |
153.2 |
10 |
10(9) |
ブリストル・マイヤーズスクイブ(米) |
152.5 |
▲2 |
11(11) |
イーライリリー(米) |
146.5 |
6 |
12(12) |
アボツト・ラボラトリーズ(米) |
133.0 |
15 |
13(14) |
アムジェン(米) |
120.2 |
20 |
14(13) |
武田薬品工業(日) |
108.6 |
6 |
15(16) |
シェリング・プラウ(米) |
95.1 |
15 |
16(15) |
第一三共(日) |
83.6 |
0 |
17(17) |
アステラス製薬(日) |
80.5 |
3 |
▽伸び率は現地通貨べ一ス。為替換算は期中平均レート
▽日本企業は06年3月期の見通し。欧米企業は05年12月期
▽決算を公表していない独べ一リンガーインゲルハイムが100億ドル超で武田と並ぶ規模とみられる
▽第一三共とアステラス製薬の2004年順位は統合前の単純合計
日本経済新聞 2006/2/19 発表
富士写、医薬品に参入 創薬VBに出資 がん・糖尿病薬開発
富士写真フイルムは医薬品事業に進出する。このほど創薬ベンチャー企業のペルセウスプロテオミクスに資本参加、同社が持つ医薬品の開発技術を生かし、がんや糖尿病向けの新薬を開発・販売する。富士写はフィルム事業で培った化合物技術を活用し、写真フィルム市場が縮小するなか医療分野を収益の柱の一つに育てる。
富士写はペルセウスの第三者割当増資を引き受け、発行済み株式の22%を持つ筆頭株主になった。出資額は約10億円。ペルセウスは東大教授らの医薬品技術をもとに研究用試薬などを開発するベンチャーで2004年度の売上高は約3千万円。
富士写はペルセウスと共同で、がんや糖尿病の治療に使う副作用の少ない抗体医薬品の開発に取り組む。化学薬品子会社、富士写真フィルムファインケミカルの製造ラインを活用し、数年後に生産を始める。
富土写は昨年、医薬や健康関連の機器・サービスを手がけるライフサイエンス事業部を設立。血液から遺伝子のDNA(デオキシリボ核酸)を高速抽出するシステムや臨床試験で使う試薬などの開発を進めてきた。
ライフサイエンス関連事業の04年度の連結売上高は約100億円。14年には1千億円にする計画で、このうち医薬品の売上高は300億円を見込む。写真フィルム市場の縮小に伴い、富士写は経営の多角化を一段と推進する方針。
| 2009年2月に第三者割り当てにより株式の77%を取得、同社は富士フィルムの子会社となった。 今後ペルセウスは、ガンや生活習慣病に対する抗体医薬品シーズや診断マーカーの開発をさらに推し進める。 |
ペルセウスプロテオミクス Perseus Proteomics Inc. http://www.ppmx.com/
ペルセウスプロテオミクスは、東京大学 先端科学技術研究センター(駒場オープンラボ)のシステム生物医学ラボラトリー(LSBM)からタンパク質発現等に関する研究成果の技術移転を受け、LSBMが誇る世界最先端の分子生物医学分野のサイエンティストと臨床医とともに、がんや生活習慣病に対する抗体医薬品を始めとするバイオ医薬品やバイオマーカーを開発しています。
2001年2月 東京大学先端科学技術センターシステム生物医学ラボラトリーの技術を基盤として設立 2002年10月 抗核内受容体モノクローナル抗体を研究試薬として販売開始 2003年10月 ベンチャーキャピタルから、6億5,000万円を第三者割当増資により資金調達 2004年5月 動脈硬化マーカーとして期待されるPTX3診断薬キットの共同開発についてシミック株式会社と合意 2005年2月 シミック株式会社グループから、3億円を第三者割当増資により調達
富士フイルム 創薬ベンチャーのペルセウスプロテオミクスに出資
抗体医薬品事業に本格参入
http://www.fujifilm.co.jp/news_r/nrj1472.html
富士写真フイルム株式会社(社長:古森 重隆、以下「富士フイルム」)は、創薬系バイオベンチャーの株式会社ペルセウスプロテオミクス(社長:松田 和之、以下「ペルセウス」)による9億9,800万円の第三者割当増資を引受け、同社発行済株式の22.0%を有する筆頭株主となりました。富士フイルムは、今後、ペルセウスの持つガンや生活習慣病などの測定マーカーを用いた診断薬/システムの開発をはじめとして、抗体医薬品※1 事業を本格的に展開してまいります。
※1 抗体医薬品 : 生体に備わっている免疫機能を活用し、特定のたんぱく質と結びつく「抗体」を活用した医薬品。特定の細胞や物質だけに作用するので、治療効果が高く、副作用も少ないと期待される。
富士フイルムは、中期経営計画「VISION75」の一環として、新規事業を積極的に推進しています。中でもライフサイエンス分野においては、昨年5月に最先端技術の事業化推進・技術交流を目的とする国際クラブ組織「コスモス・アライアンス」への加盟ならびに同クラブメンバー企業への出資を行いました。また、同年9月には臨床試験(治験)支援のパイオニア企業であるシミック株式会社とともに「富士フイルム・シミック
ヘルスケア株式会社」を設立するなど、従来のバイオイメージング事業や生化学検査事業に加え、医療・医薬分野への事業展開を目指してまいりました。
ペルセウスは、東京大学先端科学技術研究センターの技術を導入し設立された創薬系バイオベンチャーです。同社は、抗体を作るための抗原として機能する特定のたんぱく質を、煩雑なたんぱく質精製工程を経ずに大量に発現させることのできる発芽バキュロウィルス発現技術※2
を持っています。また、単一の抗原だけを認識して結合するモノクローナル抗体を作製する高度な技術※3
によって、ガンや生活習慣病に対する治療薬や診断薬のシーズ開発を推進しています。また、生活習慣病などの治療薬開発の決め手となる核内受容体※4
抗体を48種類全て保有する世界唯一の会社です。
※2 発芽バキュロウィルス発現技術 : 昆虫細胞の中で効率良く増殖するバキュロウィルスに、抗原となるタンパク質を作る遺伝子を組み込んで培養し、発芽するように抗原を発現させる技術
※3 モノクローナル抗体作成技術 : 単一の抗原のみに結合するモノクローナル抗体を細胞融合の手法を用いて安定的に作成する技術
※4 核内受容体 : 核内受容体とは、核内にあるタンパク質で、糖・脂質代謝、骨代謝、抗炎症作用、免疫抑制作用などの重要な生命機能にかかわる種々の遺伝子発現制御を行っているとされる。人には全部で48種類の核内受容体があるとされ、例えば生活習慣病の代表例である糖尿病に対して、糖・脂質代謝に関わる核内受容体を活性化させる治療薬が開発されている。
富士フイルムは、ペルセウスと協業し、ガンや動脈硬化などの生活習慣病の測定マーカーを使った診断システムを、平成20年に上市すべく開発することを手始めに、富士フイルム固有の素材を用いて生体内分子を可視化する分子イメージング技術と融合した新しい先進医療素材の開発を進めます。さらに、当社が永年写真技術開発で培った20万種類におよぶ化合物に適用して、新規医薬化合物の探索も進めます。時代を先取りする独創的製品やサービスを創出することで、事業を積極的に推進しライフサイエンス、医療、医薬品の発展に貢献すべく、取り組んでまいります。
【富士フイルムによる出資の概要】
1) 引受株数 普通株式9,980株
2) 引受価格 一株につき10万円
3) 引受総額 9億9,800万円
4) 持分比率 増資後の発行済株式の22.0%
【ペルセウスプロテオミクスの会社概要】
1) 商号 株式会社ペルセウスプロテオミクス
2) 代表者 松田和之
3) 所在地 東京都目黒区駒場四丁目7番6号
4) 設立 2001年2月1日
5) 資本金 6億3,775万円(2005年9月現在)
6) 事業内容
抗体医薬品・体外診断薬・研究用試薬・核内受容体創薬の開発
バイオ医薬品向け組換えタンパク質の製造設備の増設を決定
http://www.agc.co.jp/news/2006/0406.pdf
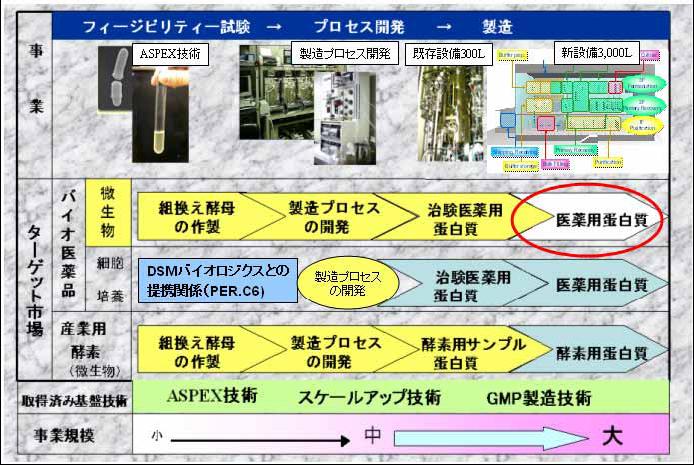
旭硝子株式会社(本社:東京、社長:門松正宏)は、バイオ医薬品原体の受託製造事業拡大のため、組換えタンパク質の製造設備の増設を決定しました。当社千葉工場(千葉県市原市)において、3000リットル規模の培養設備を含む新工場を建設することとし、本年10月に着工、2008年7月に商業生産を開始する予定です。今回増設する設備は、当社中央研究所(神奈川県横浜市)内における現有設備の10倍の規模に相当し、バイオ医薬品原体受託製造専業メーカーとしては、国内最大級の規模です。新設備は、各種の微生物をベースとした発現系による組換えタンパク質の生産に対応し、医薬品の製造規範であるcGMPに準拠するものです。
当社は、2000年に「ASPEX事業推進部」を設置して以来、中央研究所内のパイロットプラントを活用し、バイオ医薬品原体である各種タンパク質の製造プロセスの開発および治験薬の製造を中心とした事業を展開してきました。国内外の医薬・化学・食品メーカーおよびバイオベンチャー企業を対象にマーケティングを進める中で、旺盛な引き合いをいただき、既に多くのプロジェクトを受注しています。今回の増設は、これら既存のプロジェクトの量産に向けた準備であるとともに、今後拡大の見込まれているバイオ医薬品製造への潜在的な需要にタイムリーに応えていくことを目的としています。
今回の設備増強を実施することで、当社独自の分裂酵母を利用したタンパク質発現システムである「ASPEX」を活用した発現系開発ステージから、上市品の量産に至るまでの、あらゆるステージで組換えタンパク質製造に関するニーズにお応えする、ワンストップショップ体制を実現できることとなります。
当社は、発現系としてのASPEXの技術を強化するとともに、多様化する委託先メーカーのニーズにフレキシブルに対応できる生産体制を整えることで、タンパク質製造分野でのナンバーワン企業を目指します。
| <ご参考> | |
| (1) | 発現系 :微生物や細胞に遺伝子を導入して培養し、タンパク質を作らせること。 |
| (2) | cGMP:current Good Manufacturing Practice の略称。品質の良い優れた医薬品を製造するための要件をまとめた規準。WHOが1969年にGMPの採用を勧告して以来、医薬品製造に関する必須要件として世界各国において定着している。 |
| (3) | ASPEX(アスペックス):Asahi Glass Schizosaccharomyces pombe Expression System |
| (4) | ASPEX事業の概要 |
2006/6/1 旭化成メディカル/クラレメディカル
医療用中空糸膜製造合弁会社設立の件
旭化成メディカル株式会社(本社:東京都千代田区
社長:吉田
安幸)とクラレメディカル株式会社(本社:東京都千代田区
社長:堀井
秀夫)は、(株)クラレが製造販売するEVOH樹脂(商標:エバール(R))を用いた医療用中空糸膜の製造会社を共同出資で設立することについて基本合意しましたのでお知らせいたします。
1.新会社概要
(1)会社名 : A・Kメンブレン製造株式会社
(英文名 A-K Membrane Manufacturing
Co., Ltd.)
(2)代表者 : 日吉
辰夫(旭化成メディカル(株)常務取締役)
(3)事業内容 : EVOH樹脂(商標:エバールR)を用いた医療用中空糸膜の製造及び供給
(4)設 立 : 2006年6月
(5)生産能力 :
400万本/年(スタート時260万本/年)
(6)所在地 : 宮崎県延岡市
(7)商業生産開始 : 2008年5月(予定)
(8)投資額 :
約25億円(初期投資約20億円)
(9)資本金 : 4億9千万円
(10)出資比率 :
旭化成メディカル(株)50%、クラレメディカル(株)50%
(11)従業員 : 約50名
2.経緯及び目的
旭化成メディカル及びクラレメディカルの両社は、今後の透析及び血液浄化治療関連製品の安定供給のために、生産設備の共同投資を行うことが必要と判断しました。
(1)旭化成メディカルは、EVOH中空糸膜(優れた生体適合性、特に導入初期や高齢者に優しいマイルド透析)を使用する製品ラインアップを持つことで、ポリスルホン中空糸膜(世界標準の高性能膜、特に低分子量タンパクの高い除去性能)との補完効果を生かして、各透析施設における最適な治療方針への対応が可能となります。
(2)クラレメディカルは、現在、(株)クラレの倉敷事業所内にあるEVOH中空糸膜製造設備の立地について当該事業所の再編に伴い移転地を検討していたところ、旭化成メディカルよりEVOH中空糸膜による製品ラインアップ構想の話があり、人工腎臓の組立て地(大分県)に近接している延岡地区が好適と判断しました。
今回の両社合意は、倉敷事業所再編計画の一環としてEVOH中空糸膜製造工場の新立地を検討していたクラレメディカルの構想と、延岡での製造拠点のさらなる増強計画を検討していた旭化成メディカルの構想がタイミングよく合致したことにより実現しました。
<ご参考>
〔会社概要〕
1.旭化成メディカル株式会社の概要
(1)代表者 :吉田 安幸
(2)設 立 :1974年7月24日
(3)資本金
:8億円(旭化成ファーマ(株)100%出資)
※旭化成ファーマ(株)は、旭化成(株)の100%出資会社。
(4)本 社
:東京都千代田区神田美土代町9-1
(5)工 場
:延岡工場(人工腎臓向け中空糸膜製造他)、大分工場(人工腎臓他組立加工)、
中国工場(浙江省杭州市
人工腎臓組立加工)
(6)従業員数:約1,700名(2006年3月末)
(7)売上高
:401億円(2006年3月末)
(8)主要製品:人工腎臓、輸血用白血球除去フィルター、血液浄化関連製品、
プラノバ(ウイルス除去フィルター)等の開発・製造・販売
2.クラレメディカル株式会社の概要
(1)代表者 :堀井 秀夫
(2)設 立 :2001年6月21日
(3)資本金
:25億円((株)クラレ100%出資)
(4)本 社 :東京都千代田区大手町1-1-3
(5)工 場
:倉敷事業所(人工腎臓向け中空糸膜、歯科用接着・充填レジン製造他)
(6)従業員数:約340名(2006年3月末)
(7)売上高
:128億円(2006年3月末)
(8)主要製品:人工腎臓、血液浄化関連製品、歯科用接着・充填レジンなどのメディカル関連製品の開発・製造・販売
| 〔用語解説〕 | |
| 1. | EVOH樹脂(商標:エバールR)を用いた中空糸膜 株式会社クラレが世界に先駆けて事業化したEVOH樹脂(エチレン・ビニルアルコール共重合体)を使用した中空糸膜。生体適合性に優れ、活性酸素の産生、炎症反応が抑えられると評価されている。 |
| 2. | ポリスルホン中空糸膜 ポリスルホン樹脂を使用した中空糸膜。B2-MGなどの低分子量タンパクの除去性能が高く、また生体適合性及び抗血栓性に優れている。 |
| 3. | 透析(人工透析) 血液を体外に誘導し、中空糸膜(人工腎臓)を介して血液と透析液を接触させ、本来尿中に排出される尿素、クレアチニン、尿酸などの老廃物を除去して浄化された血液を体内に戻す療法(透析治療)。この療法を行う際の血液と透析液を接触させるための半透膜を容器に組み込んだものが人工腎臓(ダイアライザー)である。 素材としてはセルロース系(再生セルロース、セルローストリアセテート)、合成高分子系(ポリスルホン、EVOH、ポリアクリロニトリル、ポリメチルメタアクリレート等)がある。 |
| 4. | 血液浄化治療 血液浄化器を使用する血液浄化治療(療法)は、薬剤等の内科的治療のみでは困難な肝不 全や膠原病等の患者に適用される血液浄化に関する療法や治療システムで、血漿中に存在する病因物質等を体外循環により除去する療法である。 血液浄化器の素材としては,合成高分子系中空糸膜(ポリスルホン、EVOH、ポリアクリロニトリル、ポリエチレン等)、吸着剤,不織布等がある。 |
薬害C型肝炎訴訟、国と製薬会社に賠償責任 大阪地裁判決
血液製剤「フィブリノゲン」などを投与されてC型肝炎ウイルス(HCV)に感染したとして、近畿、中国、四国地方の患者13人が国と製造元の三菱ウェルファーマ(旧ミドリ十字)、子会社のベネシスを相手に総額7億5900万円の損害賠償を求めた薬害C型肝炎集団訴訟の判決が21日、大阪地裁であった。中本敏嗣裁判長は原告13人のうち5人について国と製薬会社の責任を認め、4人は企業側の責任のみを認定し、総額2億5630万円の支払いを命じた。原告4人の請求は棄却した。
判決は「国は非加熱製剤の危険性が明らかになった87年4月以降も非加熱製剤の規制をせず、安全性を十分に確認しないまま加熱製剤を製造承認しており、安全確保に対する認識や配慮を著しく欠いており違法だ」と指摘した。
血液製剤の製造・承認をめぐる国の安全確保義務のあり方が問われた初めての司法判断で、8月30日に判決が予定される福岡など残り4地裁の集団訴訟にも影響を与えるとみられる。
13人は20~50代の女性12人と男性1人。訴状によると、13人は81~88年、出産時などの止血剤としてフィブリノゲンなどを投与され、HCVに感染したとされる。
訴訟では、ウイルスに汚染された製剤を製造したメーカーと、製造を承認し、承認取り消しなどの規制をしなかった国の責任の有無が争われた。
国の責任をめぐっては、クロロキン製剤の副作用をめぐる薬害訴訟で95年に最高裁が示した(1)医薬品としての有用性が肯定される場合の製造承認は適法(2)副作用防止のために必要な権限を行使しなかったことが著しく合理性を欠く場合は、国に賠償責任が生じる――という二つの基準をどう適用するかが最大の争点だった。
原告側は、被告はフィブリノゲン製造が承認された64年までに研究論文などから危険性を予測できたと指摘したうえで、「承認時に有効性を示す臨床実験のデータはなく、肝炎になる恐れがあり有用性もなかった」と主張。米国が製造承認を取り消した77年以降に承認を取り消すなどの規制権限を行使しなかったことは著しく合理性を欠くとしていた。
これに対し国側は、フィブリノゲン製剤は多くの産婦を出血による死から救った医薬品で、87年の効能・効果の再評価の際にも日本産科婦人科学会などから使用継続の要望が出されていた▽87年の集団感染事件までは肝炎の感染報告もほとんどなかった――などと指摘。製剤の有用性は明らかで、製造の承認をしたことや承認取り消しなどをしなかったことは違法ではないと反論した。
このほか、輸血を受けている原告(9人)について、HCVの感染源が血液製剤と断定できるか▽血液製剤の投与が20年以上前の原告(2人)について、損害賠償請求権が消滅する「除斥期間」が適用されるか、なども争われた。
三菱ウェルファーマの調査によると、フィブリノゲンでHCVに感染した人は、80年以降に限っても1万人以上と推定されている。
毎日新聞 2006/6/22
危険な血液製剤による感染拡大を、国はいつ防げたのか。原告側は、①1964年(製造承認)②78年(米食品医薬品局による承認取り消しの翌年)③87年(青森県での集団感染)を挙げた。判決は、③について国が対策を怠った法的責任を認め、①②の時期でも国の薬事行政のずさんさを指弾した。
64年の承認時、旧ミドリ十字の申請書に添付された資料には、有効性を示す臨床試験のデータがほとんどなかった。国側は「試験が困難な場合はデータがなくても構わない。専門医による中央薬事審議会のお墨付きもあった」と主張。判決は、肝炎感染のメカニズムが未解明だった当時の状況などから国の違法性までは認めなかったが、「試験の資料はずさんだった」と明言した。
国はその後、71~78年に実施した既存医薬品の再評価で、フィブリノゲンを対象から外した。判決は「製品の名称を変えて再評価をすり抜けた」との原告側主張を追認し、「外した合理的理由がない。再評価指定すべきだった」と指摘。また77年に米国でフィブリノゲンの製造承認が取り消されていたことに触れ、「重要情報の収集や検討を怠り、医薬品の安全性確保の意識が欠如していた」と結論付けた。
さらに、87年の加熱製剤の製造承認に関しては「承認の結論ありきの方針の下、安全性確保に対する認識や配慮に著しく欠けていた」と強く非難した。
輸血や血液由来の医薬品に肝炎感染のリスクがあることは、古くから知られていた。それでも厚労省が感染拡大の責任を否定してきたのは「危険性を上回る有効性がある」との自信からだった。判決を受けたある幹部は「これでは少しでも悪い可能性があったら承認できなくなる」と今後の悪影響を懸念する。しかし、判決は、危険性や有効性を中立・迅速に判断できない薬事行政そのものを批判したと言える。
2006年7月21日 オリンパス
オリンパス、グローバルな免疫検査分野に本格参入
~生化学検査システムとの相乗効果で事業拡大を目指す~
http://www.olympus.co.jp/jp/news/2006b/nr060721immuj.cfm
オリンパス株式会社(社長:菊川 剛)は、2006年7月から免疫検査市場へ本格参入いたします。従来の生化学分析装置の技術・ノウハウを活かした免疫検査装置「AU3000i」と専用試薬を欧州から発売し、順次、米国、日本、アジアとグローバルに事業拡大をはかります。既存の生化学検査装置、および顧客サポート体制との相乗効果によって、当社の臨床診断検査事業全体の売上拡大をはかります。なお将来は、次世代医療のひとつに位置づける、遺伝子検査の臨床への応用を目指します。
オリンパスは、近年の高齢化社会やQOL(生活の質)の向上といった社会的要因を背景に、当社の事業ドメインの一つである「医療・健康分野」に注力し、医療部門、ライフサイエンス部門ともに確実に売上・利益を伸ばしています。
21世紀はライフサイエンスの時代と言われており、当社も積極的にライフサイエンス関連事業への投資を行い、2桁の年成長率を遂げて、臨床診断検査事業は、約450億円のビジネスに成長しました。
当社が臨床診断検査事業に参入したのは、1971年です。以降、生化学検査を中心に全世界でビジネスを広げ、1989年からは試薬もラインアップし、開発・生産拠点は日本、ドイツ、フランス、アイルランドとグローバルに存在しています。しかも、それらの拠点間で装置と試薬のベストマッチングを図って市場に提供しているのが他社にはない当社の強みです。近年は、装置・試薬・メンテナンス・サポートサービスなどを一括して顧客に提供する「システムビジネス」、検査1テストごとに課金する「PRT(Pay
per Reportable Test)」など、全世界的に厳しい医療環境の中において、顧客中心のビジネスを進めています。
当社は、生化学分析装置で培った自動化の技術、装置と試薬をシステムとして仕立てるノウハウを免疫検査装置に応用し、全世界でおよそ55億ドルといわれる免疫検査市場に本格参入いたします。まずは、欧州から、当社初の免疫検査装置「AU3000i」の発売を2006年7月から開始する予定です。その後は、各国の法規制認可次第、米国、日本、アジアへの導入を予定しています。当面は、甲状腺ホルモン、性ホルモン、腫瘍マーカーといった検査から参入し、以降、心筋マーカーなど検査対象を広げていく考えです。
免疫検査市場に参入することで、既存の生化学検査装置、及び顧客サポート体制との相乗効果を狙い、臨床診断検査事業全体で、3年後に600億円以上の売上を目指します。
なお、将来は、バイオ事業とのコラボレーションにより、当社が次世代医療の一つに位置づけている「遺伝子検査の臨床への応用」へと事業を展開し、テーラーメード医療の早期実現を目指します。
「AU3000i」の概要
発売時期
欧州: 2006年7月(米国、日本その他の地域は未定)
| 主な特長 | ||
| 1)高い処理能力 | 24項目同時フルランダムアクセスにより、240テスト/hを実現 | |
| 2)高い信頼性 | サンプル詰まり検知の搭載による、データ信頼性の確保 自己診断機能の充実によるダウンタイムの削減 2次元バーコード採用による、試薬情報管理の充実 |
|
| 3)優れた操作性 | 生化学検査装置のAUシリーズと共通化して、変わらぬ操作性を実現
|
|
| 基本仕様 | ||
| 測定項目 | 甲状腺ホルモン、性ホルモン、腫瘍マーカー | |
| 処理速度 | 240テスト/h | |
| 同時分析可能項目 | 24項目 | |
| 大きさ(mm) | 1700(W)×1190(D)×1435(H) | |
免疫検査について
人の健康状態の把握、病気の原因、進行具合、治療効果を客観的にとらえるために使われるのが「臨床検査」です。その臨床検査は、大きく2つに分類されます。一つは、心電図測定や血圧測定、内視鏡検査、脳波測定などのように、身体から直接情報を得る「生理検査」、もう一つは、血液や尿、便、髄液などのような身体から取り出したものから情報を得る「検体検査」です。検体検査には、健康診断等に代表される「生化学検査」、血液型の判定に代表される「輸血検査」等があり、当社が本格参入する「免疫検査」もこの検体検査の一種です。
免疫検査は、抗原と抗体の反応を利用して病気の診断や病態を調べる検査です。体内にウイルスや細菌(=抗原)が進入すると、抗原を溶解・中和して生体を防御するために、その抗原に特異的に結合するタンパク質(=抗体)が血中に作られます。また、がんや心臓疾患の場合には、ある特殊なタンパク質が作られ血中に流出することもあります。抗体と抗原は、いわば鍵と錠のような関係にあり、免疫検査は、血中の抗原やそれに対する抗体の濃度などを測定して、がんや甲状腺疾患、不妊症、心臓疾患などを調べるものです。
当社の臨床診断検査事業の歴史
1969年 自動生化学分析装置のプロトタイプを開発
1971年 生化学自動分析装置「ACA-III」を開発、臨床診断検査事業に参入
1974年
日本赤十字社へ献血者用生化学分析装置を納入
1975年 初の海外展開として、台湾市場へ参入
1976年 世界初の自動電気泳動装置「AES」開発
1977年 分析機事業部が発足
1978年 三島オリンパス(株)設立
1979年 欧州市場に参入
1982年 北米市場に参入
1984年 全自動輸血検査装置「PK7000」を発売、日本赤十字社へ納入
1989年 Human社買収(現 Olympus Life and Material Science
Europa社)
1996年 生化学自動分析装置「AU600」発売
1998年 生化学自動分析装置「AU400」発売
2001年 カード式自動輸血検査装置「ID-Gel Station」発売
2003年 Streamline社買収(現 Olympus Diagnostica
Lab-automation社)
2005年 Advalytix社買収
2006/8/21 MerLion
Pharmaceuticals
MerLion Pharmaceuticals announces the completion of a merger with
Combinature Biopharm AG and Athelas SA and first closure of a
US$30M financing round
MerLion Pharma completes tripartite merger
Advanced antibiotic drug candidates moving into clinical trials
Significant Asian biotech financing round
Broad additions to technology platform for potential partnering
MerLion
Pharmaceuticals Pte Ltd (MerLion) of Singapore, the world’s leading natural products based
drug discovery company, announces that it has completed a merger
by exchange of shares with Combinature Biopharm AG (Berlin, Germany) and Athelas SA (Geneva, Switzerland). Both
European companies become 100% subsidiaries of MerLion whose
headquarters and drug discovery research centre is based in
Singapore. Drug development of its anti-infective programmes and
nuclear magnetic resonance screening activities will be conducted
from Berlin.
Dr Tony Buss, CEO of MerLion said “This major expansion of our
capabilities, combined with proven drug discovery technologies
and promising clinical candidates, position MerLion for its next
exciting phase of growth. The company will continue its lead
discovery activities in a range of therapeutic areas and will
focus on the clinical development of anti-infective drugs.”
Dr Harald
Labischinski, CEO of Combinature Biopharm and the new Chief
Scientific Officer of MerLion, said "Combinature is very
pleased to enter into such a strategic agreement with the leading
natural compound research company and is now for the first time
in the position to forward the new company’s most advanced antibiotic
compounds from late stage pre-clinical development through phase
I and phase II clinical. We expect to start our first clinical
programmes with a novel mode of action resistance breaker
antibiotic as well as with a new subclass of a broad spectrum
antibiotic class within a few months from now."
Dr Christine Deuschel, CEO of Athelas, said “MerLion offers Athelas an
exceptional opportunity to progress the development of our novel
anti-pathogenicity platform. The integration of Athelas’
DiVi Technology
will provide MerLion with a broad and completely novel way of
discovering new molecules based on a mechanism of action
unexploited to date”.
The company has also completed the first closure of US$ 25M from
a US$30M round of financing, which will be completed in full
during the fourth quarter of 2006. This funding will propel the
company towards an initial public offering within two years.
The round, led by Aravis Venture of Switzerland and Bio*One
Capital Pte Ltd of Singapore, represents one of the largest
private rounds of funding raised for a drug discovery and
development company in the region.
Ms. Swee Yeok Chu, CEO of Bio*One Capital and Mr. Jean-Philippe
Tripet, Managing Partner of Aravis stated: “We believe that this cross border
merger and financing is a landmark deal in Asia that confirms the
ability of biotechnology companies to successfully develop from
Singapore, capitalising on international alliances, funding from
international investors, as well as strong local infrastructure
that supports the growth of the company. With this financing and
acquisitions, MerLion has now built a profile that compares with
the best emerging biotechnology companies globally.”
Other participants
in this round of funding include Nomura Research and Advisory,
Aurelia Private Equity, Brandenburg Capital, Bioveda Capital,
Novartis Venture Fund Mitsubishi Corporation and 3i Group
Investment LP.
Michael Toenes of BC Venture GmbH , Juergen Leschke, Management
Partner Aurelia Private Equity, Dr. Clemens Doppler of 3i Group
Investment LP and Dr Dirk Honold, former CFO of Combinature
stated: “The new company is now in the
exciting position to further fill and advance the pipeline and to
start clinical testing with very promising antibiotic drugs which
have already shown exciting profiles. By the transaction the
combined entity will have a strategic position to enter into the
highly attractive and growing markets in the important area of
novel anti-infectives.”
In addition to
progressing at least two anti-infective candidates into clinical
proof of concept studies and developing the growing portfolio of
earlier candidates towards the clinic, MerLion will retain its
strong partnership alliances in natural products drug discovery
and will expand in two main areas;
Novel Anti-Infectives Discovery
The acquisition of the anti-infectives DiVi discovery platform of
Athelas, which received an award at the 2005 Interscience
Conference on Antimicrobial Agents and Chemotherapy (ICAAC),
provides MerLion with strong target generation capabilities and
proprietary drug discovery screening systems in the area of
bacterial pathogenicity.
Nuclear Magnetic Resonance (NMR) Screening
The experienced NMR screening group based in Berlin will continue
to utilise their expertise and technology with existing partners
and in support of ongoing MerLion portfolio projects. This
technology is the subject of increasing interest to the industry
and is capable of advancing discovery by closely identifying how
active compounds interact with drug targets and how these
interactions may be optimised.
MerLion would like to recognise the professional services
provided during this complex transaction by Jones Day, CMS
Munich, Wong Partnership, Schellenburg-Wittmer, Vischer,
PriceWaterhouseCoopers, Ernst & Young and Maidavale
Consulting.
Note to Editors
About MerLion Pharmaceuticals http://www.merlionpharma.com/
MerLion Pharmaceuticals is the industry partner-of-choice in
natural products drug discovery. It maintains the world's largest
and most diverse collection of natural product samples and enters
multiple risk-share collaborations utilising its unique natural
products chemistry expertise and proven high throughput screening
capabilities.
The company’s current collaboration partners
include Abbott Laboratories, Arpida SA, Astellas Pharma Inc.,
Boehringer Ingelheim, Cancer Research Technologies Ltd, Dow
AgroSciences, the Institute of Molecular and Cell Biology
(Singapore), Johns-Hopkins (USA), Merck and Co, NovImmmune SA,
Nura Inc, Novartis Institute for Tropical Diseases, Sankyo Co
Ltd. and Schering-Plough Inc.
日本経済新聞 2006/8/29
医療機器 革新のうねり
患者に優しい新技術続々 光学・素材…強み生かす
体の異常を調べ、病気を治療する医療機器に、急速な技術革新の波が押し寄せている。国内各社が得意のデジタル技術や微細化技術を応用し、病気の早期発見につながる検査法や、患者に負担の少ない治療法を相次いで開発。海外の大手が押さえる安定市場だったが、新規参入や大型M&A(企業の合併・買収)が動きはじめている。
薬の錠剤のように水と一緒にのみ込むだけで、内視鏡検査ができる。こんな技術が実用段階を迎えた。オリンパス子会社のカプセル型内視鏡は、SF映画「ミクロの決死圏」の潜航艇さながらに体内を巡り、がんなどを見つけ出す。
長さ2.6センチ、幅1.1センチの機体の中に電荷結合素子(CCD)カメラと照明用の発光ダイオード(LED)、無線送信装置を詰め込んだ。デジタルカメラと内視鏡で培った光学・微細化技術を応用し、細長く蛇行する小腸を撮影する。昨年末に欧州で発売し、国内でも厚生労働省への承認申請を準備中だ。
切開せず治療
従来の内視鏡は口や肛門から入れる。患者の負担は大きいうえ、大人で7メートルに及ぶ小腸を内部から見ることはできなかった。オリンパスは消化器向けの内視鏡で世界シェア7割を握る大手。医療事業の2006年3月期は連結売上高の3割弱にすぎないが、営業利益で約770億円と他部門の営業赤字を埋める屋台骨になっている。「デジカメなどに比べて価格が安定しており、今後も高成長・高収益が見込める」(菊川剛社長)
患者の肉体的な負担と経済的負担を両方軽減させるための工夫も加速している。日本の電機や素材の技術が原動力になっている。テルモが開発した新型のカテーテル(医療用細管)システムは、手足の血管から挿入して心臓まで達する手術が可能だ。長さ2メートル、太さは0.3ミリの細くて腰のある金属に独自の素材技術を盛り込んだ。狭心症や心筋梗塞などの治療はこれまで胸を切開する「血管バイパス手術」に頼ってきた。カテーテル治療は患者にとって傷が小さくなるメリットがあり、急速に広がっている。カテーテルは一式約30万円と高いが、入院期間は最短で1日に短縮され、患者の最終的な経済負担や医療コストは減るケースがほとんどだ。
三菱電機は原子力発電所の技術を応用した高性能の「粒子線治療装置」事業で海外進出を狙う。エックス線を使う一般的な放射線治療装置より患部に集中させやすく、体の深部にある肺がんなどの治療に有効だ。一台40億円程度と高価だが、導入した病院には遠方から患者が押しかけ、海外からの引き合いも強い。
買収額3兆円
国内の医療機器の市場は医療費抑制策の影響で年間約2兆円でほぼ横ばい。しかし世界では20兆円の市場があり、特に先端医療分野で急速な成長が見込める。先進国では高齢者が増加し、新興国では保険制度の整備が進んでいる。成長市場を狙い、大型のM&Aも相次ぐ。
今年3月末、米大手のボストン・サイエンティフィックが同業の米ガイダントを買収、巨大医療機器メーカーが発足した。買収額は270億ドル(約3兆1200億円)にのぼった。独シーメンスも6月末、バイエルの診断薬事業を買収。有力技術を狙うM&Aの流れは止まらない。
規模や経営体力で海外大手に劣る日本勢でも「世界市場の競争を考えると、企業買収も選択肢」(東芝メディカルシステムズの桂田昌生社長)と考える企業も出てきた。だが日本企業が世界市場で存在感を示し始めれば、逆に海外の大手企業から狙われる可能性も出てきそうだ。
国内審査、長い道のり 厳しい基準、産学官で克服
「重い心臓病に悩む人にも長期間使ってもらえるのではないか」。テルモ子会社の米テルモハートの野尻知里社長は期待を込める。テルモは体内に埋め込んで使う補助人工心臓を開発し、欧州で2007年春までの発売にメドをつけた。
補助人工心臓は心臓移植手術以外に治療の道がない患者が使う機器。これまでの製品は長期間使うと血栓や感染症が発生しやすく、移植手術を待つまでの「つなぎ」と考えられていた。
テルモの製品は血液を送り出す羽根車の構造や材料に工夫を凝らして、耐久性を大幅に高めた。5年以上の連続使用が可能とみられる。特に日本では移植医療が難しいこともあり、医師や患者からの期待は高い。
だがこの新技術も国内では今後ようやく臨床試験に入る段階で、発売時期のメドは立っていない。テルモは欧米人に比べて小柄な日本人の体格に合わせて小型化を進めたが、「日本では臨床試験の許可を得るのにも時間がかかる」(野尻社長)。
欧米の2世代前
日本で治療に使う医療機器の承認審査期間は平均で2年以上かかり、米国の倍程度。医療機器の安全性や有効性を審査する医薬品医療機器総合機構の人員が少ないうえ、臨床試験を手掛ける医療機関の体制も不十分だ。テルモのように臨床試験以前の段階で時間がかかるケースも多い。その結果日本で使われる医療機器は、欧米に比べて二、三世代前古いものというケースが多くなる。
たとえば心臓のぺースメーカーは、国内市場を米メーカー3社がほぼ独占している。海外て次々と出る新製品だが日本では臨床試験が遅れ、日本に投入されるのは2世代以上前の機種ばかり。
メーカーも国内を開発の基盤にしている限り、開発で海外メーカーに立ち遅れる。心臓の血管を内側から押し広げて治療する筒状バネの「ステント」では、米ジョンソン・エンド・ジョンソンがあっという間に国内シェア7割を獲得。血管が詰まるのを防ぐ薬がステントからしみ出す新型品を海外で開発し、04年に日本に投入。短期間で切り替えが進んだ。
手術ロボに助成
医療機器は万一の事故があれば、メーカーの責任が厳しく問われる世界。特に患者の体内に入れて、治療する機器のリスクは大きい。日本メーカーは要素技術を持ちながらも商品化に及び腰だ。厳しい承認基準は当然だが、「革新的な技術ほど製品化は難しく、企業だけでの取り組みには限界がある」(テルモの和地孝会長)。
壁を乗り越えるためには産学官が力を合わせるしかない。日立製作所と信州大学医学部などは、脳外科専用の手術ロボットの開発を進める。患者の頭に小さな穴をあけ、メスの機能をもつ細い筒を入れ、腫瘍を摘出する。頭蓋を外す大手術に比べ、
患者負担は減る。
手術ロボットは薬事法上、医療機器としてのガイドラインがまだない。そこで日本内視鏡学会は手術ロボットの操作マニュアルなどの作成に着手、環境整備に乗り出した。国も研究助成に乗り出し、既にプロトタイプで4人の患者の手術に成功した。
産学官の医療機器の専門家らで構成するコンソーシアムは今春、遺伝子診断機器や除細動器など7テーマを選び、国や産業界が協力すれば日本の強みを生かせる医療機器開発が可能との提言をまとめた。企業は医療現場と対話をしながら、挑戦していく必要がある。
米ボストン・サイエンティフィック
Boston Scientific、3.1兆円でガイダントGuidant
を買収へ=J&Jとの買収合戦に勝利
AP通信によると、米医療機器大手ガイダントは25日、同業の米ボストン・サイエンティフィックに約272億ドル(約3兆1000億円)で身売りすることで合意した。米日用品大手ジョンソン・エンド・ジョンソン(J&J)との間で繰り広げられていた買収合戦は、ボストン・サイエンティフィックの勝利に終わった。
ガイダントのジム・コーネリアスCEO(最高経営責任者)は、「(ボストンへの身売りが)ガイダントの製品を使用している患者や当社の従業員、顧客、株主にとって最善と考える」との談話を発表した。
ボストン・サイエンティフィックは17日に、J&Jの買収提示額を上回る提案を行い、ガイダント取締役会はボストンの提案支持に方針を転換していた。その後、J&Jはさらなる買収額の引き上げを提示できなかった。今後、両社の株主総会で承認を受けた後、当局の認可を受けて、正式に買収が決まる。ボストン・サイエンティフィックは、第1四半期中に買収を終える見通しだとした。
2006/1/12 http://management.blog45.fc2.com/blog-entry-116.html
朝日新聞 2006/8/30
国と製薬会社に賠償命令 C型肝炎訴訟で福岡地裁判決
汚染された血液製剤を投与されC型肝炎ウイルス(HCV)に感染させられたとして、九州・沖縄などの患者18人が国と製造元の三菱ウェルファーマ(旧ミドリ十字)と子会社ベネシス(いずれも本社・大阪市)を相手取り、総額11億6600万円の損害賠償を求めた「薬害C型肝炎九州訴訟」の判決が30日、福岡地裁であった。須田啓之裁判長は原告18人のうち11人の訴えを認め、国と製薬会社に計1億6830万円の賠償を命じた。7人については請求を棄却した。
全国5地裁に提訴されたC型肝炎集団訴訟では6月の大阪地裁に続く司法判断だが、大阪と同様、原告が血液製剤を投与された時期・種類によって原告への賠償責任の有無が割れる形になった。
原告は22~58歳の女性15人、男性3人。77~88年に出産や手術の際の止血剤などとして血液製剤「フィブリノゲン」や「クリスマシン」を投与された。
訴訟では、汚染されている危険性が高い血液製剤を製造・販売した製薬会社と、それを承認し、危険性がわかった後も承認取り消しなどの規制をしなかった国の過失や違法性がどの時点で生じるかが争われた。
国の責任については(1)その時点の医学的知見の下で副作用を上回る有用性がある場合は製造承認は適法(2)副作用防止のため権限を行使しなかったことが著しく合理性を欠く場合は違法――との判断を示したクロロキン薬害訴訟最高裁判決(95年)が基準となった。
6月21日の大阪地裁判決は、この基準を薬事行政の経過に適用した場合、どの時点で国に違法性が生じるかどうかを検討。フィブリノゲンについては、青森県で集団感染発生が報告された87年4月以降に生じると認定した。また、製薬会社の責任が生じるのは、HCVの感染力をなくすため施した処理法を変更した結果、逆に危険性を高めた85年8月以降とした。クリスマシンについては、有用性は否定できないとして賠償責任はどの時点でも認定しなかった。
原告側は、血液製剤の製造が承認された64、76年の時点で、HCVに感染する危険性やC型肝炎が重い症状になることが知られており、ずさんな方法で承認された製剤に有用性は確認できないと主張。被告側は当時から有用性はあり、違法性や過失はないと反論していた。
栄研化学株式会社と大塚製薬株式会社の業務提携および資本参加に関するお知らせ
栄研化学株式会社(本社:東京都文京区、以下、栄研化学)と大塚製薬株式会社(本社:東京都千代田区、以下、大塚製薬)は、以下のとおり、資本参加を含めた業務提携を行うことについて合意に達し、本日開催の各社取締役会において決議の上、業務提携に関する基本契約を締結いたしましたので、お知らせいたします。
1.提携に至った背景
国内の臨床検査薬業界は、医療費抑制策の継続基調は変わらず、一段と経営の効率化と合理化が迫られる状況となっております。このような厳しい市場環境が続く臨床検査薬業界において、持続的かつグローバルに成長を遂げていくためには、『研究開発力の強化』と『営業力の強化』を行い、競争力を高めることが最善の戦略であるとの共通認識で両社は一致し、業務提携を進めることといたしました。
大塚製薬は、「Otsuka - people creating new products
for better health worldwide」という企業理念のもと、革新的な製品の開発と強い営業力により新しい市場の創造に取り組んでおります。
また、栄研化学は、スクリーニング検査薬を中心とし、健診市場での製品開発力と営業力に確固たる事業基盤をもっております。
今回の基本合意は、今後、益々、グローバルに競争激化が予想される臨床検査薬市場の中で、両社の確立された事業基盤を有効に活用し業務補完することが、相互の発展と成長に繋がるとの考えで、両社が一致したものであります。
さらに、本提携の協力関係を発展させるため、併せて資本参加を行うことと致しました。
2.業務提携の内容および資本参加の内容
(1)業務提携の内容
臨床検査薬市場において、両社が競争力を強化し、メリットを享受できるよう、販売・市場育成、研究開発、技術の相互利用などを協力し合います。
具体的には、両社でシナジー効果が創出できる製品毎または開発品毎に個別の契約を締結していきます。
(2)資本参加の内容
両社の信頼・協力関係を深め、業務提携をより円滑に進めるため、大塚製薬は、栄研化学の普通株式を一部取得することとしました。日本マスタートラスト信託銀行株式会社(退職給付信託
田辺製薬口)より、1,500,000 株(発行済株式の6.3%)を取得する予定です。
3.両社の概要(平成18 年3
月31 日現在)
(1)栄研化学
① 名称 栄研化学株式会社
② 主な事業内容
体外診断用医薬品の製造販売および体外診断用自動分析装置の販売並びにLAMP法を使用した遺伝子検査関連製品の製造販売
③ 設立年月日 1939 年(昭和14 年)2 月20 日
④ 本店所在地 東京都文京区本郷一丁目33 番8 号
⑤ 代表者 代表執行役社長 黒住 忠夫
⑥ 資本金 6,897 百万円
⑦ 総資産 29,595 百万円(連結)
⑧ 売上高 23,551 百万円(連結)
⑨ 従業員数 616 名(連結)
⑩ 大株主構成及び持株比率 略
(2)大塚製薬
① 名称 大塚製薬株式会社
② 主な事業内容
医薬品・臨床検査・医療機器・食料品・化粧品の製造、
製造販売、販売、輸出並びに輸入
③ 設立年月日 1964 年(昭和39 年)8 月10 日
④ 本店所在地
東京都千代田区神田司町二丁目9番地
⑤ 代表者 代表取締役社長 樋口 達夫
⑥ 資本金 6,791 百万円
⑦ 総資産 881,134 百万円(連結)
⑧ 売上高 753,139 百万円(連結)
⑨ 従業員数 18,448 名(連結)
⑩ 相手方との関係 特別な関係はありません
4.提携の日程
平成18 年9 月7 日
栄研化学、大塚製薬取締役会決議
平成18 年9 月7 日 業務提携基本契約書の締結
5.今後の見通し
今後、両社は提携効果の早期達成を図るべく、全力を尽くしてまいりますが、本提携が業績に与える影響につきましては、今後精査していく予定であり、現段階で詳細は未定です。
第一化学薬品株式会社の株式の取得(子会社化)に関するお知らせ
当社は、本日開催の取締役会において、第一三共株式会社(社長:庄田
隆)の完全子会社である第一製薬株式会社(社長:森田
清、以下、第一製薬)の100%子会社、第一化学薬品株式会社(社長:蘆田
伸一郎、以下、第一化学薬品)の発行済み全株式を取得し、子会社化することを決議し、本日、第一製薬と株式譲受契約を締結いたしましたので、お知らせいたします。
1.株式取得の理由
当社は平成18年度にスタートさせた中期経営ビジョンのもと、「際立つ、高収益企業」への変革をめざし、高収益化を実現する成長事業、新事業の創出を重要課題として取り組み、その中で高機能プラスチックスカンパニーは、IT、自動車、メディカル関連の3戦略分野を中心とした業容拡大を進めています。メディカル関連では素材技術と高機能プラスチックスカンパニーの海外事業ノウハウを強みに、検査(検査薬、検査用具)、治療(医薬品、治療部材)の領域で事業展開していますが、さらなる事業拡大のためには素材技術を生かせる製品開発力、生産技術力、営業力の強化・拡大が課題となっていました。
第一化学薬品は、検査薬から医薬品バルク、創薬支援の事業展開により幅広い分野で医療に貢献し、特に検査薬事業において研究開発・生産・営業の密接な連携による市場ニーズに合致した新製品の迅速な開発、上市を進め、急速に拡大しています。なかでも脂質領域の検査試薬であるHDL及びLDLコレステロール検査薬は、国内はもとより、世界でもトップシェアを獲得しています。
当社は、第一化学薬品の優れた開発力、生産技術力、営業・マーケティング力と当社の素材技術、海外事業ノウハウを融合することで大きなシナジーが期待できると考えております。具体的には検査領域における素材から販売までのバリューチェーンを生かした製品競争力強化や当社が保有する海外事業のネットワークを活用した販売拡大、治療領域における第一化学薬品が有する医薬品バルク生産技術、創薬支援技術の獲得による新事業創出、等があります。
これらを慎重に検討した結果、両社の事業競争力がさらに強化され大きな成長が図れるものと判断し、当社はこの度、第一製薬より第一化学薬品の株式を譲り受けることを決定しました。
2.異動する子会社(第一化学薬品)の概要
(1)商号 第一化学薬品株式会社
(2)代表者 代表取締役社長 蘆田 伸一郎
(3)所在地 東京都中央区日本橋3-13-5
(4)設立年月日 昭和22年7月10日
(5)主な事業の内容 検査薬事業、研究用試薬事業、化学薬品事業、薬物動態研究事業
(6)決算期 毎年3月31日
(7)従業員数 604名(平成18年3月末)
(8)主な事業所
営業所:東京、名古屋、大阪など10箇所
工 場:茨城、岩手
研究所:茨城
(9)資本金 1,275百万円
(10)発行済株式総数 普通株式16,470千株
(11)株主 第一製薬株式会社100%
(12)最近事業年度における業績の動向
平成17年3月期 平成18年3月期
売上高 22,593百万円 22,803百万円
営業利益 2,176百万円 2,551百万円
3.株式の取得先
(1)商号 第一製薬株式会社
(2)代表者 代表取締役社長 森田 清
(3)本店所在地
東京都中央区日本橋3-14-10
(4)主な事業の内容
医薬品等の製造及び販売並びに輸出入
4.取得株式数、取得価額および取得前後の所有株式の状況
(1)異動前の所有株式数 0株
(2)取得株式数 16,470千株
(3)異動後の所有株式数 16,470千株
5.日程
平成18年9月11日
取締役会で株式取得を決議、株式譲受契約を締結
平成18年10月2日 株券引渡し期日
6.今後の見通し
本件に伴う当期の業績予想の修正は予定しておりません。
<ご参考>積水化学のメディカル関連事業
事業開始:昭和58(1983)年
売上高 :実績 平成17年度 115億円
計画 平成18年度 255億円(第一化学薬品連結後)
3年後 平成20年度 420億円
5年後 平成22年度 500億円
事業拠点:2営業所(東京、大阪)
研究所(大阪)
2工場(兵庫、山口)
海外事業会社(中国・北京)
海外販売会社(ドイツ、米国など7社)
事業内容:検査、治療領域で下記の事業を展開しています。
事業領域 技術 代表的製品 検査領域 検査用具 ・射出成型
・高分子重合・真空採血管
・血清分離剤
・凝固促進剤検査薬 ・超微粒子重合
・高分子表面制御・検査薬用ラテックス
・梅毒検査薬分析用カラム ・液体クロマトグラフィー充填剤重合
・クロマトグラフィー技術・糖尿病用分析カラム 治療領域 テープ医薬品 ・医用粘着剤設計
・貼付テープ製造・腰痛パテックス
・狭心症テープクリーン成型受託 ・クリーン精密成型
・樹脂配合・気管切開カテーテル
・血液回路用部品歯科向け機器 ・高周波誘導加熱 ・義歯焼成炉
日本経済新聞 2006/9/19
積水化学 創薬支援に参入 抗体医薬の候補品生産
積水化学工業は創薬支援事業に参入する。がんなどの病巣を狙い撃ちして副作用を最小限に抑える「抗体医薬」の候補品を効率よく作る独自技術を開発。来年にも候補品の受託生産と、特に需要の大きい候補品のカタログ販売に乗り出す。将来はこの技術を自社内で活用し、抗体医薬の自社創薬を目指す。
抗体医薬は「抗体」と呼ぶ免疫たんぱくを製剤化したもの。抗体医薬の侯補品は、病気のカギを握る重要なたんぱく質をネズミなどに注射し、その血液を精製して得るのが一般的。だがたんぱく質の種類によっては免疫反応が弱く、抗体が手に入らない場合がある。
同社は重要たんぱく質に別の小さなたんばく質を複数結合し、免疫反応を起きやすくさせる独自技術を開発。従来法では難しかった15種類の重要たんぱく質に対する抗体を得ることに成功した。この技術を活用し創薬支援事業を手がける。
抗体医薬の現在の世界市場規模は約1兆5千億円。抗がん剤や抗リウマチ薬などが売り上げを伸ばしており、2010年には同5兆円程度に拡大する見通し。これに伴い、抗体医薬の創薬支援事業の需要も拡大するとみられている。
日本経済新聞 2006/10/14
武田・エ一ザイ 新薬国内発売早める 世界で同時に治験 欧米からの遅れ4年→1年内に
武田薬品工業とエーザイは医療用新薬の国内発売時期で、海外に比べて平均4年あった遅れを1年以内に縮める。海外を先行させていた「臨床試験(治験)」を初めて日米欧でほぼ同時に実施し、新薬の早期発売を望む患者の声に応える。新薬の治験や承認審査期間を短縮する規制緩和の動きを背景に、製薬業界で同様の動きが広がりそうだ。
製薬会社が新薬を実用化するには、医療機関に委託して人を対象に実施する治験が必要。国内では治験に手間と時間がか
かることが発売遅れの最大の原因になっている。患者が集めにくく、実施できる医療機関も限られているため、3-7年程度かかる。商品化を急ぐ製薬会社は海外で先に治験を実施するケースが多かった。
武田薬品は「重症敗血症」の治療薬を対象に日米欧で一斉に治験に入った。重症敗血症では、末期がん患者ら免疫力が低下した人が細菌に感染して重度の炎症を起こし、死亡することもある。既存薬が少なく、国内でも新薬が期待されている。2010年度までの発売を目指す。
エーザイも重症敗血症治療薬で、日本、米国、.欧州連合(EU)諸国、ブラジルなど10カ国以上の計250医療機関を通じて今年度中にも順次、治験に着手する。09年度の日米欧での承認申請を狙う。
武田とエーザイは各国の委託先である医療機関が同じ治験計画に沿って、互いのデータを活用して進める方式を採用。国内の治験も海外のデータで補うことで、治験期間を短縮する9臨床試験後に各国で承認申請し、商品化する。審査にかかる時間は各国で異なるが、日本での発売遅れは1年以下に短縮できる可能性が高い。
日本は米国に次ぐ世界で二番目の医薬品市場。製薬会社にとっては、新薬の特許期間(通常20-25年)内にいかに早く新薬を発売できるかが収益を大きく左石する。このため、第一三共やアステラス製薬も「同時治験を検討する」としている。
同時治験は欧州と米国で盛んに実施されており、最近では韓国などアジア諸国も参加し始めている。世界の製薬大手はこれを活用することによって、各地で迅速に新薬を投入する体制を整えてきた。
厚生労働省は日本人症例の少ない同時治験のデータ活用に慎重な姿勢を示していたが、日本が出遅れている現状や患者の声も考慮し、同時治験を後押しする姿勢に転換している。
「国内治験の空洞化」深刻 欧米承認の新薬使えない事態も
厚生労働省によると、1993年に1200件あった臨床試験(治験)の届け出数は2005年に497件まで減少した。製薬企業が国内での治験を敬遠する「治験の空洞化」が深刻化。新薬の承認が進まないため、抗がん剤など欧米では使える薬が国内で使えない事態も招いている。
医薬産業政策研究所の調査によると、04年に世界売上高が150位以内の医薬品のうち、日本で未発売のものが45品目あった。国内で承認されていない薬を医師が個人輸入し、保険外で治療に使うケースもある。ただ、保険診療と保険外診療の併用は違法な「混合診療」にあたるため、患者は薬代だけでなく、本来なら原則3割負担で済む保険診療分まで全額負担しなければならない。
厚労省は緊急避難措置として昨年から、医療機関(患者)の要望があり、英米独仏4カ国のいずれかで承認済みの薬については、国内で治験が始まった段階で「混合診療」を容認した。このルールが適用されると全額自己負担となるのは薬代だけで済む。
厚労省は新薬の審査・承認作業を欧米並みに短縮しようと今月、「承認審査等推進室」を新設した。製薬企業に海外での治験データの活用や世界同時治験を促す。国の審査期間は米国の約1年に対し日本は約2年かかる。今後は新薬の有効性を判定するのに必要な基準などを明確にして製薬会社に示す。
富士フイルム 新たに超音波画像診断分野に参入
ZONE Sonography技術により画期的な高画質と小型化を実現
FUJIFILM 超音波画像診断装置 FAZONE(ファゾーン)
M 新発売
富士フイルム株式会社(社長:古森
重隆)は、富士フイルムメディカル株式会社(社長:加藤
久豊)を通じ、最先端の技術であるZONE Sonography技術により、高画質と小型化を両立させたフルデジタル超音波画像診断装置「FAZONE(ファゾーン)
M」を12月より発売いたします。
超音波検査は、検査時の患者さまへの負担が少なく、またリアルタイムに画像を観察できることから、腹部検査、乳腺・甲状腺検査、産婦人科などの幅広い臨床領域で使われています。特に近年、女性の乳がん罹患率が増加しているため、乳腺超音波検査のニーズが高まりつつあります。さらに技術の進歩により装置の小型化が進み、検査室だけでなく病棟でのベッドサイド、ICU、救急、集団検診などの用途に、持ち運んで使うことができるポータブル超音波装置の市場も拡大しています。
今回発売する超音波画像診断装置「FAZONE M」は、超音波のビームを細く絞ることで高分解能化を図ってきた一般的な超音波画像構築技術とは異なる新発想のZONE
Sonography技術により、従来技術が持っていた限界を乗り越え、先進の機能・性能を実現しました。「FAZONE
M」は超音波ビームを絞らず広範囲に送信し、大きなゾーンで大量のエコーデータを高速に収集し、画像構築に際して高度な画像処理を行う事によって画期的な高画質を実現しています。
「FAZONE M」は、高度な画像処理技術により、体内における最適な音速(超音波の伝播速度)を推定し、それに基づいて画像を構築します。この音速補正機能により、臓器や体型の違いに左右されない、高い分解能を安定して得ることに成功しました。この機能により、例えば、受診者の体型の個人差が大きい乳腺超音波検査においても、高画質の画像を安定的に得ることができます。当社がこれまで提供してきたマンモグラフィ検査に最適なデジタルX線画像診断システム「FCR
PROFECT CS」と今回あらたに提供するフルデジタル超音波画像診断装置「FAZONE
M」の併用により、乳がんの早期発見に貢献したいと考えています。
「FAZONE M」のもう一つの大きな特長が、一台で、検査室などで使い勝手がよく高画質な据え置き型超音波装置と、2.5kgと超軽量かつ高画質のポータブル超音波装置の二とおりの使い方が可能なコンバーティブル機能です。検査室での使用から病棟のベッドサイド、さらに集団検診における活用など、一台で幅広い用途にご使用いただけます。
富士フイルムは、医療事業を成長戦略の一つの柱として、事業展開を強力に推進しています。従来のデジタルX線画像診断システムFCR、電子内視鏡システムにフルデジタル超音波画像診断システムを追加し、さらに医用画像情報システム「SYNAPSE」などを組み合わせることにより、各施設の幅広い画像診断ニーズに対応した最適なソリューションを提供してまいります。
本製品を、平成18年10月28日よりシェーンバッハ砂防・全共連ビル(千代田区)で開催される日本超音波医学会の関東甲信越地方会第18回学術集会付属機器展示会に出展いたします。
1. 発売日 平成18年12月
2. 販売名 FUJIFILM 超音波画像診断装置 FAZONE M
(薬事認証番号: 218ADBZX00041000)
3. 標準ユーザー渡し価格(税別) 4500万円(基本仕様)
4. 主な特長
(1) ZONE Sonography技術
ZONE Sonographyは、画期的な高画質と小型化を実現した、超音波のデータ収集と画像構築に関する先進的な技術です。
[1]
大きなゾーンで大量のエコーデータを高速収集
一般的な超音波装置では、超音波のビームを細く絞ることで高分解能化を図っていました。しかしながら体内の音速は物理的に決まっているため、ビームを細くすればするほどデータの収集に長い時間がかかり、画質向上の制約となっていました。
ZONE Sonographyでは、幅が広い超音波ビームを送信し、大きなゾーンで大量のエコーデータを高速に収集します。この先進のアプローチにより、データを瞬時に収集できるため、先進的で高度な画像処理を新たに加えることが可能です。
[2] チャネル・ドメイン・プロセシング
一般的な超音波装置では、超音波のビームフォーミングと画像構築をカスタムハードウェアで行っていたため、柔軟性に乏しく小型化が困難でした。ZONE
Sonographyでは、ビームフォーミングをソフトウェアで実現するとともに、収集した大量のエコーデータをメモリに蓄え、ソフトウェアで高度な画像処理を行うチャネル・ドメイン・プロセシングにより、高画質の超音波画像を構築しています。
(2) 音速補正機能
一般的な超音波装置では、体内の音速を一定とみなして超音波画像を構築していましたが、実際は診断部位や体型により体内の音速には±5%程度の違いがあるため、画像の分解能を悪化させる原因の一つになっていました。「FAZONE
M」は、ZONE Sonography技術に基づく高度な画像処理により、最適な音速を決定し超音波画像を構築します。この機能により、高分解能の画像を安定的に得ることができるようになります。
(3) コンバーティブル機能
「FAZONE M」は、ZONE Sonography技術により、画期的な高画質と小型化を両立させることに成功し、検査室などで使い勝手がよく高画質な据え置き型超音波装置と、2.5kgと超軽量かつ高画質のポータブル超音波装置の二とおりの使い方が可能なコンバーティブル機能を実現しました。
5. 主な仕様
表示モード : B-mode, M-mode, Color Doppler, Power Doppler,
Pulsed Wave Doppler
観察モニタ : スーパーカート部 13インチカラーLCD
スキャンエンジン部 5.8インチカラーLCD
起動時間 : 約20秒
電源 : AC100V 50/60Hz 最大6A
外形寸法/重量 : スーパーカート部 610(W)×850(D)×1290~1410(H)mm/84kg
スキャンエンジン部 250(W)×250(D)×73(H)mm/2.5kg
日本経済新聞 2006/10/31
キヤノン 遺伝子診断事業に参入 1時間で検査 2010年にも製品化
キヤノンは遺伝子診断事業に参入する。特定の遺伝子を1時間で検出できる技術を開発、病気の診断や薬の副作用が発生する可能性の有無を調べる装置に応用する。キヤノンの撮影技術や微細加工技術を活用し、小型で安価な遺伝子診断装置として、2010年にも製品化したい考え。
開発したのはキヤノンの米国現地法人の100%子会社、キヤノンUSライフサイエンス。特定の遺伝子の有無だけでなく、遺伝子配列のわずかな違い(個人的差異)も1時間で見分けられる。従来法では2日から2週間程度かかっていたという。同じ働きをする遺伝子でも個人差があり、薬の効き目が異なったり副作用が発生する。遺伝子の個人差を短時間で容易に特定できれば、患者の体質に応じて最適な治療を提供する「テーラーメード医療」につながる。
細い溝にDNA(デオキシリボ核酸)の検体と試薬を流しながら遺伝子を増幅する。さらに熱を加えて遺伝子の二重らせん構造を解き、わずかな配列の違いを特定する。米ベンチャーのキャリパーライフサイエンス(マサチューセッツ州)から遺伝子増幅などの技術供与を受けた。Caliper
Life Sciences http://www.caliperls.com/
卓上型の小さな診断装置を開発すれば、例えば患者のベッドサイドで抗がん剤を投与する前に副作用の可能性を調べることなどが可能になる。まず試作品を作り、診療現場で精度や有用性を確認するため欧米の医療機関との連携を模索する。
キヤノンは今後の成長戦略として医療・バイオ分野を強化する方針を掲げている。例えばデジタルカメラに使う撮影技術は、蛍光色素を使って遺伝子の有無を確認するといった技術に応用できるという。
遺伝子診断の市場規模は2010年ごろに世界で1兆円程度に達するとの見通しもあり、技術開発を強化する。
▼遺伝子診断
血液や組織に含まれる特定の遺伝子を調べ、それを手掛かりにがんなどの病気の診断や発症しやすい体質、薬の効き目や副作用などを判別する技術。診断の目印となる遺伝子の探索や、微量の遺伝子でも検出できる技術の開発を各社が競っている。
日本経済新聞 2006/11/4
MediGene
release
茶カテキン原料の塗り薬 米で「植物由来」初承認 三井農林
三井農林が開発した高純度茶カテキンを原料とする皮膚病用の塗り薬が今月、米食品医薬品局(FDA)から新薬として承認を受けた。米国では漢方薬など植物成分由来の薬は承認されておらず、この茶カテキン薬が米国の植物由来医薬品の第1号となった。
三井農林はこれを足がかりに茶カテキン薬の自社開発を加速し、医薬品事業への本格参入を急ぐ。
カテキンは高い殺菌作用などを持つ。承認を受けた塗り薬は、製剤化や臨床試験を担当した独ベンチャー、メディジーン(ミュンヘン市)が来年後半にウイルス性皮膚病用に発売する。三井農林は米子会社を通じ、茶葉から抽出した高純度カテキンを原料供給する。
三井農林は米国立がん研究所と組み、茶カテキンを原料とするがんの治療・予防薬の自社開発を進めている。10件以上の臨床試験を進めており、2010年ごろの製品化を目指す。
Medigene http://www.medigene.com/englisch/index_e.php
2005年9月29日 三井農林
米国FDAに初のカテキン原薬を使った新薬を申請
ドイツの医薬品開発ベンチャー「メディジーン社」は28日、弊社の高純度カテキン「ポリフェノンE」を使った皮膚疾患「コンジローマ」の治療軟膏に関する新薬申請書を米国FDA(食品医薬品局)に提出しました。
FDAは日本の厚生労働省にあたり、審査が順調に進めば18ヵ月後に認可される予定です。その際、世界で初めてFDA基準による植物由来の原薬を使った医薬品が誕生します。
ポリフェノンEは茶葉から抽出された総カテキンを90%以上まで精製した高純度カテキンで抗酸化、抗菌、抗がんなどの作用があるとされるEGCg(エピガロカテキンガレート)が60~70%含まれています。
弊社の原征彦常務(食品総合研究所所長、農学博士)は北京がんセンターとの共同研究で、ヒトパピローマウィルスによるコンジローマを抑制することを発見、97年に国際特許を取得しています。その後、00年から弊社はメディジーン社と提携して新薬の開発に取り組んで来ました。
弊社は04年12月末にポリフェノンEをFDAに原薬として仮登録し、今年9月22日に正式登録しました。今回、メディジーン社が申請した医薬品は、この原薬を使ったものです。
2005年1月5日 三井農林
三井農林の茶カテキン、ポリフェノンEが医薬品主剤として世界初の商業化へ
三井農林株式会社は、茶葉から抽出した茶カテキンの研究開発と商業化において世界をリードしてきました。2004年度は、飲料メーカーが茶カテキン入り緑茶に注力していること、飲料以外の用途も急速に広がっていることから、茶カテキンの年間売上高を70億円と昨年度比倍増と見込んでおります。
さらに、茶カテキンには、優れた抗菌、抗ウィルス作用があることから、三井農林では当社製造の茶カテキンである「ポリフェノンE」(登録商標)を使って医薬への活用に取組んできました。
今般、ドイツのバイオテクノロジー会社メディジーン社が、アメリカにおいてポリフェノンE軟膏を用いたコンジローマ(パピローマウィルスによる皮膚疾患:性器や肛門にイボができる病気)の治療試験(臨床第3相試験)を行い、高く且つ持続的な有効性と優れた安全性を示す臨床結果を得ました。同社では、既に昨年春ヨーロッパにおける同様の臨床試験に成功しており、これにより、2005年春には米欧の当局(FDA)に新薬販売認可を申請する予定です。
コンジローマは、良性ではあるが伝染性の腫瘍で、難治といわれています。北米では約1400万人、ヨーロッパでは1500万人が、その原因であるパピローマウィルスに感染しているとされています。メディジーン社は、米欧の大手医薬会社と提携し、この新薬を2006年から販売する予定で、その売上高は年間百数十億円以上になると予測しております。また、試験結果からポリフェノンE軟膏は他の皮膚疾患(皮膚がんの前駆症状)にも有効とみられることから、将来的には数百億円程度の市場規模となる可能性を有しております。以上の通り、茶の成分(茶カテキン)であるポリフェノンEを主剤とする医薬品が、早ければ2006年中には認可され商業化される可能性が高まっています。このことは、茶の抽出物のみならず天然植物抽出物が、米国FDA規格において世界で初めて原薬として認知され商業化されることを意味し、画期的な意義を有しております。
これに呼応し、三井農林では、原料手当てから原薬製造まで一連の投資に着手し、原薬の供給体制の整備を進めています。具体的には、中国に茶原料および中間原料基地を確保しました。また、ポリフェノンE商業生産のため製薬会社であるアルプス薬品工業株式会社〔岐阜県〕の工場施設を借受け、三井農林が約4~5億円の投資を行って製造設備の設置に取組んでいます。さらに、三井農林は、ポリフェノン事業統括本部にポリフェノンE原薬事業部を新設し、社内体制の強化を図っています。一方、三井農林では、別途ポリフェノンEを使い、がん予防薬の開発に取組んでいます。
1997年以来、米国有数のがん研究機関と協力して、米国の著名な大学研究所、医療機関研究所8ヶ所でポリフェノンEを使った多種類のがんに対する予防薬としての臨床実験を行っています。
がんの前駆症状(発病前だが兆候あり)に対し、ポリフェノンEを投与することにより、いかに進行がおさえられ、症状が改善するかという臨床実験で、第2相試験が進行中です。
米国では、100兆円にも上るといわれる医療費の削減のため、副作用の少ない天然物を予防薬に活用しようとする研究に大きな期待が寄せられています。前述のがん研究機関では、多種多様の天然植物抽出物による予防薬の開発に取組んでいますが、中でも茶抽出物を重視し、三井農林の協力を得てポリフェノンEによる臨床の成果に期待を寄せています。ポリフェノンEが、がん予防薬としての臨床実験に成功すれば、この流れに大きな弾みをつけることになります。以上の通り、三井農林では、ポリフェノンEを使用した医薬ビジネスを5年後には 100億円程度の売上げ規模にすべく体制を整えています。また、食品分野においてもこの高度な茶カテキンの研究・開発力を生かし、ポリフェノンを大きなビジネスに育て上げる計画です。
First US approval for a
German biotech company
· MediGene's second drug approved
· US Market launch by partner
Bradley Pharmaceuticals, Inc. scheduled for the second half of
2007
· USD 14 MM milestone payment due
from Bradley Pharmaceuticals
Martinsried/Munich ?
October 31, 2006. The biotech company MediGene AG (Frankfurt) has
obtained marketing authorization from the US regulatory authority
FDA (Food and Drug Administration) for Polyphenon®
E Ointment, a drug
indicated for the treatment of external and
perianal genital warts. US market launch of the drug by
MediGene's US marketing partner Bradley
Pharmaceuticals, Inc.
is expected during the second half of 2007. Upon approval of
Polyphenon® E Ointment, MediGene will receive
a milestone payment of USD 14 MM from Bradley Pharmaceuticals,
Inc.
The active substance in Polyphenon® E Ointment is an extract from
green tea leaves with a defined catechin composition. MediGene
expects an annual peak sales potential for Polyphenon®
E Ointment of up to
USD 100 MM in the USA. MediGene is also planning to submit
Marketing Authorization Applications for the drug in European
countries before the end of this year.
External genital warts are one of the most common and fastest
spreading venereal diseases worldwide. Approximately 14 million
people in the United States and 15 million people in Europe are
infected by human papilloma viruses (HPV type 6 or 11), which
cause external genital warts.
Dr. Peter Heinrich, Chief Executive Officer of MediGene AG,
comments: "MediGene is the first German biotech company to
obtain US marketing authorization for a drug. It is our second
drug approved following our cancer drug Eligard®
which is available
on the European market. Both Polyphenon®
E and Eligard®
should continue to
significantly increase MediGene's revenues. In addition, we will
quickly drive forward our clinical programs for developing new
drugs against cancer and autoimmune diseases to market maturity.
MediGene's clinical drug candidates EndoTAG®, RhuDex®, and our oncolytic herpes simplex
viruses provide a very promising potential."
Dr. Ulrich Delvos, Chief Operating Officer of MediGene AG, comments: "We are pleased to have obtained the approval of Polyphenon® E Ointment on the PDUFA date already. The immediate approval highlights the excellent job done by our preclinical and clinical developments, production, regulatory affairs, quality assurance, and project management teams. The outstanding technical expertise and dedicated commitment shown by our partner Mitsui Norin, the manufacturer of the active substance Polyphenon® E, have also been an essential prerequisite for obtaining approval."
Bradley President and CEO Daniel Glassman stated, "The approval is very exciting news for Bradley. We look forward to working with MediGene to offer physicians an important and beneficial therapy for their patients. Bradley is well positioned to help make Polyphenon® E Ointment a success by leveraging both Bradley's promotional capabilities and our established relationships in the OB/GYN and dermatology markets."
The approval for Polyphenon E Ointment has been made out to the name VeregenTM. The future trade name has to be decided yet.
MediGene AG is a publicly quoted (Frankfurt) biotechnology
company located in Martinsried/Munich, Germany, with subsidiaries
in Oxford, UK and San Diego, USA. MediGene is the first German
biotech company with a drug on the market. The second drug,
Polyphenon® E Ointment, has been approved by
the FDA. In addition, several drug candidates are currently in
clinical development. MediGene also possesses innovative platform
technologies. The company's core competence lies in research and
development of novel approaches in anti cancer and autoimmune
therapies. Thus MediGene focuses on indications of high medical
need and great economic opportunities.
Bradley Pharmaceuticals, Inc. was founded in 1985 as a specialty pharmaceutical company and markets to niche physician specialties in the U.S. and 38 international markets. Bradley's success is based upon strategically expanding from an Acquire, Enhance and Grow to an In-License, Develop and Bring to Market business model: In-license phase II and phase III drugs with long-term intellectual property protection; Develop these products and submit completed clinical studies to the FDA for NDA approvals and commercialization; Bring to Market these patent-protected brands to fill unmet needs and leverage Bradley's marketing and sales expertise to increase shareholder value. Bradley Pharmaceuticals is comprised of Doak Dermatologics, specializing in therapies for dermatology and podiatry; Kenwood Therapeutics, providing gastroenterology, OBGYN, respiratory and other internal medicine brands; and A. Aarons, which markets authorized generic versions of Doak and Kenwood therapies
日本経済新聞 2006/11/23
製薬大手4社の今期 株主配分、6000億円超す 純利益合計を上回る
製薬会社が株主配分を拡大している。大手4社の2007年3月期の予想純利益合計が5605億円なのに対し、配当と自社株買いによる株主配分総額は6千億円を超える見通しとなった。武田薬品工業の9月末の現金及び現金同等物残高が1兆6500億円近くに達するなど製薬大手各社は手元流動性がもともと豊富。配分拡大には稼げば稼ぐほど手元資金が積み上がり資本効率が悪化するジレンマを解消する狙いもある。
「株主資本が減っても株主配分を優先する」。アステラス製薬の野木森雅郁社長はこう言い切る。アステラスの今期の純利益予想は1190億円。配当総額435億円と9月末までに実施した自社株買い費用を足すと既に1134億円に達する。
さらに下期に設定した3千万株、1500億円の自社株買い枠についても「株価をあまり気にせず3千万株買うつもり」(野木森社長)とほぼ全額消化することを宣言。今期、配当と自社株買いにつぎ込む金額は推定2500億円程度と純利益の2倍を超え、株主資本が減少するのは確実だ。
武田も今期の株主配分額が純利益を上回りそう。配当総額と10月までの自社株買い費用の合算は、既に純利益の87%にあたる2697億円に達した。11月以降も買い付けを続行しているとみられる。
武田は株主資本利益率(ROE)を14%以上に保つ方針を打ち出している。今期の純利益3100億円から逆算すると、ROE
14%を達成するには株主資本を前期より2千億円規模で減らす必要がある。エーザイや第一三共も純利益の半分以上を配当と自社株買いに充当する。
資本効率の悪化は投資家の不評を買いかねない。経営者はまた、過剰な現預金で被買収リスクが増すことを警戒している面もある。
金融機関からの借り入れが容易になり、手元に現預金を置く必要が薄れたのも一因。財務が健全でキャッシュフローが潤沢な製薬大手は「安心して貸せる先」(大手銀行)だ。「製薬大手なら1兆円規模の借り入れも可能」と試算する証券会社もあり、新薬導入やM&Aの費用は調達しやすい環境にある。
| 製薬大手4社の今期の業績と株主配分 (単位億円、配当総額は9月中間期末の発行済み株式数で試算、 配分率は純利益に対する配当原資と自社株買い費用の占める割り合い) |
|||||||||||||||||||||||||
|
2006/12/3 日本経済新聞
伊藤忠、創薬に進出 米社と合弁 がん向けなど「タネ」発掘
伊藤忠商事はバイオ分野で世界最大のベンチャーキャピタル、米MPMキャピタルと組み、医薬品の開発事業に進出する。新設した合弁会社を通じ、がん治療薬などの「タネ」となる候補物質を外部から購入、安全性や効果を確認する事業に特化する。主に製品の販売権を日本の製薬会社に転売して収益をあげる。候補物質を選び出すには資金やノウハウが必要で、欧米勢に比べ開発力の弱い日本の製薬会社の需要は大きいとみている。
米国に新会社ジャパン・ブリッジ(デラウェア州)を設立した。資本金は130万ドル(約1億5000万円)でMPMが80.8%、伊藤忠が19.2%を出資。2007年度に事業拠点を日本へ移し、09年度までに国内外の機関投資家から計100億円規模の増資を募る計画。
新会社はまずMPMの投資先や海外製薬会社から、3種類程度の候補物質を日本を含むアジアで開発・販売する権利を購入する。伊藤忠グループの臨床開発支援会社などと連携し、製品化を目指す。新薬の販売権は他の製薬会社に転売するか、自社で販売する。がんや中枢神経領域などの薬に重点を置く。
一般に新薬の製品化には候補物質の探索から始めると9-17年、投資額は平均約500億円かかる。経営体力の弱い製薬会社が一貫して手掛けるには年々ハードルが高くなっている。
米国では候補物質の発掘に特化した事業モデルが定着しているが日本では一貫した開発体制が主流だった。今後は日本でも発掘を外部に頼り開発リスクを軽減する製薬会社が増えそうだ。合弁会社は10年度をメドに日本で株式公開を目指す。
| MPM Capital | ||
| 本社所在地 | : | 111 Huntington Ave., 31st Fl., Boston, MA 02199 |
| 設立 | : | 1992年 |
| 創立者 | : | Dr. Ansbert Gadicke |
| GP数 | : | 9名 |
| 運用資産 | : | 23億ドル |
| 投資先企業数 | : | 約70社 |
| 伊藤忠商事はMPMが運営するファンドに対して2002年8月に20百万ドルを投資 | ||
| 伊藤忠商事によるMPMの投資先ベンチャーへの直接出資 | ||
| 2003年11月 Metabasis Therapeutics, Inc. 2004年 ARYx Therapeutics, Inc. Arriva Pharmaceuticals, Inc. 2005年 Peptimmune, Inc. |
||
伊藤忠が米国優良バイオベンチャーARYx Therapeutics, Inc.へ出資
伊藤忠商事は、消化器、循環器、代謝性疾患領域などの新薬開発ベンチャーである、米国ARYx Therapeutics, Inc.(以下ARYx社)に対してこのたび100万ドルの出資を行いました。
ARYx社のリードインベスターは、伊藤忠商事が戦略提携を締結している、世界最大のバイオベンチャーキャピタルグループである米国MPM Capital(以下MPM)で、伊藤忠商事はMPMが運営するファンドに対して2002年8月に20百万ドルを投資しております。MPMの投資先ベンチャーへの直接出資は、昨年11月に実施したMetabasis Therapeutics, Inc.に続き、2社目になります。ARYx社は、米国シリコンバレーのサンタクララに本社を置き、心房細動・胃食道逆流症の2つの開発品目が現在臨床試験に入っています。彼らの技術は、既に市場で流通されている製品の中で、副作用の強いもので販売中止、若しくは販売自粛を余儀なくされた製品を、独自のプラットフォーム技術により市販されている既製品に手を加え、理論的に副作用が出ない新薬開発を特徴とするバイオベンチャーです。上記いずれかの品目において、POC(proof of concept=概念実証) が確立されれば、同種の問題を抱えている他の流通されている製品にも着手可能となり得る、将来性の高い有望なバイオベンチャーです。
今後伊藤忠商事はARYx社の対日展開を推進することにより、MPMと協調して同社の経営支援を進めることで、早期のIPOを実現したい考えで、さらには、同様の直接出資を加速化することにより、バイオ分野における収益基盤の拡大につとめてまいります。
■各社概要
ARYx Therapeutics, Inc.本社所在地 : 2255 Martin Avenue, Suite F, Santa Clara, CA 95050 設立 : 1997年 代表者 : Dr. Peter Milner 従業員数 : 約30 名 主要株主 : MPM、Nomura International、Orbimed, Merlin BioMed
MPM Capital 本社所在地 : 111 Huntington Ave., 31st Fl., Boston, MA 02199 設立 : 1992年 創立者 : Dr. Ansbert Gadicke GP数 : 9名 運用資産 : 23億ドル 投資先企業数 : 約70社
伊藤忠が米国優良バイオベンチャーPeptimmune,Inc.と資本・業務提携
この度、伊藤忠商事は、代謝性疾患、自己免疫疾患領域などの新薬開発ベンチャーである、米国Peptimmune, Inc.(以下Peptimmune社)に対して、100万ドルの出資を行い、また対日技術移転のパートナーとして業務提携も締結いたしました。
Peptimmune社のリードインベスターは、伊藤忠商事が戦略提携を締結している、世界最大のバイオベンチャーキャピタルグループである米国MPM Capital(以下MPM)で、伊藤忠商事はMPMが運営するファンドに対して2002年8月に20百万ドルを投資しております。MPMの投資先ベンチャーへの直接出資は、2003年11月に実施したMetabasis Therapeutics, Inc.,を皮切りに、2004年には、ARYx Therapeutics, Inc., Arriva Pharmaceuticals, Inc.へ投資しており、Peptimmune社は4社目になります。
Peptimmune社は、米国大手バイオ製薬会社Genzyme社からのスピンオフベンチャーです。 マサチュセツ州ケンブリッジに本社を置き、開発の注力疾患領域としては、代謝性疾患、免疫反応に関する自己免疫疾患やアレルギー疾患の治療が焦点領域であり、抗肥満薬、多発性硬化症、尋常性天疱瘡(皮膚病)を開発品目として保有しています。開発ステージとしては、多発性硬化症が前臨床試験、抗肥満薬と尋常性天疱瘡は第一相臨床試験に入っています。自己免疫疾患の領域では、現在の治療法では、非特異的な免疫抑制が主流なため重篤な副作用が生じる可能性がある中、同社の治療法は、疾患を引き起こす免疫細胞のみを中和させ、疾患の進行を止めることを標的としており、難病治療の新薬を開発しうる、将来性の高い有望なバイオベンチャーです。
今後伊藤忠商事はPeptimmune社の対日展開を推進することにより、MPMと協調して同社の経営支援を進めることで、早期のIPOを実現したい考えで、さらには、同様の直接出資を加速化することにより、バイオ分野における収益基盤の拡大につとめてまいります。
Peptimmune, Inc. 本社所在地 : 64 Sidney Street, Cambridge MA 設立 : 2002年 代表者 : Mr. Thomas Mathers 従業員数 : 約30名 主要株主 : MPM Capital, New Enterprise Associates,
Vanguard, Prism Ventures, Genzyme Corporation
世界最大のバイオベンチャーキャピタルMPM Capitalと医薬品開発・販売ベンチャー「JapanBridge, Inc」を設立
伊藤忠商事株式会社は、世界最大のバイオベンチャーキャピタルグループである米国MPM Capital(以下MPM)と共同で、医薬品開発・販売ベンチャー会社「JapanBridge, Inc.」(以下JB)を2006年11月21日に米国デラウェア州に設立しました。
JBは、欧米で開発が進められている、新薬のアジア(日本を含む)における開発・販売権を、MPMの投資先であるバイオベンチャー及び大手製薬会社からインライセンスし、日本国内で臨床開発(CROを利用)を実施。その後、製薬会社へアウトライセンス、或いは自社販売により収益化を目指します。JBは、2010年度には日本でのIPOを目指します。
今回の資金調達(シリーズA)1.3百万ドルにより、JBはインライセンスする開発品目の選定を進めます。その後1年後に予定される資金調達(シリーズB)では、拠点をデラウェア州から日本へ移し、インライセンスした開発品目の臨床開発を開始します。またシリーズB以降には、有力製薬会社1社をJBに招聘し、臨床開発及び許認可取得のためのサポートを得る予定です。またこのパートナー会社は、将来の開発品目導出や共同販売の候補となります。
伊藤忠はJB立上げ時より参画することにより、将来のIPO・M&Aによるキャピタルゲインのみならず、中間体ビジネス、MR派遣ビジネス、治験ビジネス、開発ツール・ソフトウェアビジネス、物流ビジネス等を狙います。
先端技術分野においてバイオ医薬ビジネスを重視している伊藤忠は、2002年にMPMの3号ファンドへ20百万ドルの出資をして以来、MPMとは良好な関係を有していますが、MPMと共同でJBを設立し、MPMとの関係を一層強固なものにします。MPMと協力して日本におけるJB立上げのみならず、今後海外における有望案件の共同開発・推進も狙い、バイオ医薬分野での収益の拡大を目指します。
JapanBridge, Inc.
所在地 : 1209 Orange Street, Wilmington, Delaware, USA 資本金 : 1.3百万ドル 暫定CEO : Mr. Vaughn Kailian(元COR Theraeutics社 創設者) 出資者 : MPM 1.05百万ドル(80.8%)、伊藤忠 0.25百万ドル(19.2%) 取締役構成 : 3名(MPM2名・伊藤忠1名)
富士フイルム 循環器部門向け医療画像情報システムメーカー Problem Solving Concept Inc.を買収し、メディカル事業領域を拡大
富士フイルム株式会社(社長:古森
重隆)は、米国の販売子会社FUJIFILM Medical Systems
USA, Inc.を通じて、循環器部門向け医療画像情報システムメーカーである米国
Problem Solving Concept
Inc.社(本社:米国 Indianapolis、以下ProSolv社)の発行済全株式を取得し、ProSolv社を富士フイルムグループの100%子会社といたします。
ProSolv社は、設立以来蓄積した高いソフトウエア技術を背景に、主に心臓疾患の診断と治療をおこなう循環器部門向けの医療画像情報システム(Cardiology-PACS)を独自に開発し、2000年より販売しています。ProSolv社のCardiology-PACSは、心臓疾患に代表される循環器疾患の診断・治療に必要な動画表示、心電図との同期、計測機能などに加え、カスタマイズ可能な充実したレポート作成機能が高く評価され、現在米国を中心に世界350施設の循環器部門で導入されています。
富士フイルムは、先進・独自の技術をもって、『人々のクォリティ
オブ ライフのさらなる向上に寄与していく』という企業理念のもと、メディカル事業を主要な事業領域の一つとしてグローバルに展開し、1981年に世界に先駆けて開発したデジタルX線画像診断システム「FCR」(Fuji
Computed Radiography)や、放射線科における各種モダリティ画像をネットワーク上で管理する医療画像情報システム(PACS:Picture
Archiving and Communications System)「SYNAPSE」を通じ、画像診断の効率化に貢献しています。
IT化が進む医療の現場においては、画像診断情報を一元的に管理し、診療結果を短時間で正確にレポートとして記録し、診断や治療を担当する医師やその他の医療スタッフがいつでも情報共有できるPACSの導入ニーズが高まっています。その一環として今まで普及が遅れていた循環器部門のPACS導入は急速に進むと見込まれており、今後成長が期待されている市場です。また、大規模な施設では、院内の複数の部門データを一元管理することが求められており、大量の医療画像を扱う放射線部門と循環器部門間の画像情報共有に対する必要性も高まっています。富士フイルムの「SYNAPSE」は、これまで放射線部門用PACSとして世界中の1000を超える医療機関に導入され、高い評価をいただいておりますが、今回の買収により、「SYNAPSE」にCardiology-PACSの機能を付加し、より幅広い医療画像を扱う画像診断情報システムへと発展させることが可能となります。今後富士フイルムは、循環器部門のPACS化、さらには放射線部門と循環器部門での画像情報共有を求める世界の施設向けに、SYNAPSEを展開していきます。
富士フイルムは、「メディカル・ライフサイエンス事業」を重点事業分野とした新たな成長戦略を中期経営計画の基本戦略として掲げ、設備投資や研究開発の大幅強化とともに、積極的なM&Aの展開による新たな事業拡大を進めており、今回の買収もこうした成長戦略の一環です。今後の当社メディカル事業の成長につなげるとともに、医療の質や効率の向上、人々の健康の維持増進、クォリティ
オブ ライフのさらなる向上に貢献してまいります。
<Problem Solving Concept Inc.の概要>
設立 : 1989年12月
社長・CEO : Thomas Feigenbaum
所在地 : 米国Indiana州Indianapolis
事業内容 :
循環器部門向けの医療用画像情報システム(Cardiology-PACS)の開発、販売、保守
日本経済新聞 2007/3/21
英グラクソ筑波研究所閉鎖へ 日本での創薬研究 欧米大手が縮小・撤退
ファイザーも検討、メルクは集約
英製薬大手のグラクソ・スミスクライン(GSK)は今夏にも、創薬研究の国内拠点である筑波研究所(茨城県つくば市)を閉鎖する。欧米大手では米メルクが日本の研究所を減らし、米ファイザーも中央研究所(愛知県武豊町)の閉鎖を検討中だ。各社が世界規模で進めている研究開発拠点の集約の一環で、日本では基礎研究を縮小・撤退し、製品化の工程に近い開発部門に経営資源を集中させる。
GSKの筑波研究所は1991年に約200億円を投じて建設し、「新薬の種」となる物質を探す創薬研究を手掛けている。跡地は売却を軸に検討する。筑波研究所に勤務する約100人の研究者は日本法人の開発部門に異動させる方向だ。開発部隊の陣容拡充により臨床試験(治験)などを強化し、新薬の早期製品化や欧米で先行投入した薬の国内発売を目指す。
GSKの英米両国にいる創薬研究者は数千人規模に達する。2006年1-12月期に2ケタ増益を果たすなど業績は堅調だが、研究開発の効率を高めるために創薬研究については米英に集約するなど地域ごとの役割を明確にする。
世界最大手の米ファイザーも全世界で一部事業からの撤退方針を打ち出したことに伴い、約390人の社員が勤める中央研究所の閉鎖を検討している。主力薬の特許切れなどで業績が低迷している米メルクは昨年、傘下の万有製薬が妻沼研究所(埼玉県熊谷市)と岡崎研究所(愛知県岡崎市)を相次ぎ閉鎖、日本国内の研究はつくば研究所(茨城県つくば市)に集約した。
欧米各社は世界各地で分散して創薬研究を手掛けることで独自性の高い新薬の開発を目指してきた。ここに来て日本の研究所を閉鎖するのは、研究機能を薬の領域ごとに一本化したり、研究開発費の効率運用に向けて非中核分野から撤退するため。日本の拠点は欧米に比べ規模が小さく、研究領域も重なることが多いため縮小・撤退の対象になりやすい面がある。
欧米製薬大手の研究所再編
メルク(万有製薬)
岡崎研究所(大量生産の研究、約70人)→06年に閉鎖
妻沼研究所(製剤の研究、約70人)→ 同上
つくば研究所(創薬研究、約450人)→存続
ファイザー
中央研究所(創薬研究、約390人)→閉鎖の計画
グラクソ・スミスクライン
筑波研究所(創薬研究、約100人)→07年夏に閉鎖
高崎研究所(製剤の研究、約50人)→存続
日本経済新聞 2007/3/24
薬害C型肝炎 「国に責任」 東京地裁も 製薬3社の過失も認定
血液製剤「フィブリノゲン」などの投与でC型肝炎に感染したとして、患者21人が国と製薬会社3社に計約13億5千万円の損害賠償を求めた薬害肝炎訴訟の判決が23日、東京地裁であった。永野厚郎裁判長は「肝炎感染の危険性の警告を怠った」として国と製薬会社の責任を認定。13人に計約2億5900万円を支払うよう命じた。うち7人は製薬会社のみに賠償を命じた。
別の血液製剤「クリスマシン」などについては三菱ウェルファーマ(旧ミドリ十字)、日本製薬など製薬会社の責任を初めて認定。「リスクが高かったのに代替製剤のない病気に使用を限定しなかった」として1984年1月以降感染した患者への賠償を命じた。同裁判長はフィブリノゲン投与による肝炎感染の過失責任が生じた時期について、国は加熱処理した同剤を製造承認した「87年4月以降」、製薬会社は社内で肝炎ウイルス処理法を変更した「85年8月以降」と認定。国については「必要な情報収集をすれば、C型肝炎感染リスクが相当程度あることを前提に対策が取れた」と批判。三菱ウェルファーマなどは「ウイルス処理法変更で感染リスクが増大したことを警告しなかった」と指摘した。
同種訴訟では大阪、福岡両地裁も国と製薬会社の責任を認めている。
2007/4/19 日本経済新聞夕刊
後発薬の日本ユニバーサル インド大手が買収
インドの製薬大手、ザイダスグループ(グジャラート州)は後発薬の日本ユニバーサル薬品(東京都青梅市、松岡邦衛社長)を買収する。26日に現金で全株式を取得する。インドの製薬会社が日本企業を完全子会社にするのは初めて。日本ユニバーサルと取引がある医薬品卸を通じて全国に4千カ所ある製品納入先の医療機関に販路を広げ、ザイダスの後発薬を売り込む。
買収額は明らかにしていない。ザイダスは2006年9月に日本法人のザイダスファーマを設立し、日本市場に参入した。すでに厚生労働省から「医薬品外国製造業者」の認定を受け、インドから製品輸入が可能。今年度中に国内での販売承認を厚労省に申請する予定で、販路構築が課題だった。
日本ユニバーサルは特許切れになった薬と同じ成分で作る低価格の後発薬分野で、胃炎・胃潰瘍の治療薬など6品目を生産している。06年12月期の売上高は1億5400万円。粉薬製造技術に強みを持つが、新製品開発に必要な資金力が乏しく、ザイダスの傘下入りを決めた。
ザイダスはインドの製造業界5位。07年3月期の売上高は4億1400万ドル(約490億円)の見込み。欧米など世界40カ国で事業展開している。ザイダスは買収後も日本ユニバーサルの社名や製品ブランド、経営体制を維持する。
インドのザイダスグループがGE市場に参入
インドでジェネリック(GE)薬や原薬の供給を行う製薬企業ザイダスグループ(グジャラート州、会長兼社長・パンカジュ・P・パテル氏)が、日本のGE市場に参入することになった。都内に日本法人「ザイダスファーマ」を設立し、9月1日から営業を開始した。流通・販売網を持たないため、国内GEメーカーなどと半年以内の提携を検討しており、2007年をめどに最初の製品投入を目指す。
100%子会社の日本法人は8月25日、東京都新宿区に設立され、資本金は現在100万円(近く増資予定)。社長には、エーザイの渉外室長など日本の製薬業界で30年以上の経験を持つという川端一博氏が就任した。成長目標など詳細は「具体的にはまだ決まっていない」としている。
日本法人によると、ザイダスグループは1952年に設立された製薬企業で、年商は約375億円。循環器、女性のヘルスケア、呼吸器、疼痛管理、感染症領域を主力としている。世界40カ国に事業拠点を持ち、6000人以上の従業員がいる。
同社は、07年をメドに最初の製品を投入する計画で、循環器などが中心とみられるが、今後提携する企業との交渉の中で品目数を含め決めるという。親会社からの導入のほか、提携企業の製品を扱うとしている。
GE薬のほか、原薬、中間体、製剤などの共同開発、共同販売、受託製造といった分野でも日本の製薬会社との提携を検討している。候補には、GEメーカーだけでなく、新薬メーカー、創薬ベンチャーも視野にある。
親会社のパテル会長兼社長は、日本法人を通じ「創業以来、低価格・高品質の医薬品を供給することにより医療分野のニーズを満たすことを常に目指してきた」とし、「日本の皆様にも貢献する機会をつかみたいと思っている」とコメントしている。
ザイダス・グループ(Zydus Cadila) http://www.zydus.co.jp/
ザイダス・グループ(Zydus Cadila)は, インド西部の大都市・アーメダバードにある著名なL.M.薬科大学で講師をしていた故Ramanbhai B. Patelによって、1952年、Cadila Pharmaceuticals として設立されました。
同社は、1993年にはインド国内第2位の製薬会社に成長しましたが、1995年、Zydusという名称の下で、事業を再構築しました。
現在は、インド国内は「Cadila Healthcare」、海外は「Zydus」 の名で事業を展開しております。
過去10年間のあゆみ
売上高 :売上高は7倍以上の増加。
買 収 :インド: German Remedies Limited
フランス: Alparmaのフランス子会社Recon Healthcare
合弁事業:インド: Altana Pharma(Byk Guldenの関連会社)
アメリカ: Onconova社
オーストラリア: Mayne Srabhai社
研究開発:新薬の探索・開発を目的としたザイダス研究所をアーメダバードに設立。
2004年12月、最初のIND。
2005年度の研究開発費は、総売上高の約7%。
世界展開:アメリカ、フランス、ブラジル、アイルランド、南アフリカ等での子会社の設立。