Back
2003/01/06 第一製薬/サントリー
医薬品事業新会社「第一サントリーファーマ(株)」事業開始のお知らせ http://ir.daiichipharm.co.jp/netir/TopU?event=ViewWhatsNew&itemId=104619
サントリー(株)の医薬事業部門が従来行ってきた事業活動の全てが新会社に承継 され、本年1月よりその事業活動を開始いたしました。
日本経済新聞 2005/4/28
2005/5/26 第一サントリーファーマ http://www.dsup.co.jp/news/2005/0526.html
第一製薬グループの第一サントリーファーマ株式会社(本社:東京都千代田区、代表取締役社長:中山讓治)は、2005年10月1日付けで社名を「第一アスビオファーマ株式会社(DAIICHI
ASUBIO PHARMA CO., LTD.)」に変更するとともに、本社を東京都港区に移転することになりましたので、お知らせします。 http://www.dsup.co.jp
2005年9月14日
第一製薬
第一サントリーファーマ株式会社の完全子会社化に関するお知らせ http://ir.daiichipharm.co.jp/TopU,itemId,132681,event,ViewWhatsNew,locale,ja_JP.html
第一製薬株式会社(本社:東京都、社長:森田清、以下、第一製薬)は、サントリー株式会社(本社:大阪府、社長:佐治信忠、以下、サントリー)との間に、同社が保有する 第一サントリーファーマ 株式会社(本社:東京都、社長:中山讓冶、以下、第一
サントリーファーマ)の全株式を本年9月15日に購入する旨の合意書をこのたび締結いたしましたのでお知らせします。 第一製薬の完全子会社 とするとともに、同社が本年9月27日をもって実施する第三者割当増資200億円を全額引受け、同社の財務体質を強化することにより、第一製薬グループの医薬品事業の体制整備を加速します。 第一アスビオ
ファーマ株式会社 」に変更します。
2.第一サントリーファーマ株式会社(Daiichi
Suntory Pharma Co., Ltd.)
日本経済新聞 2003/8/8
第一製薬は日米欧の新薬の開発業務を統括する機能を日本から米国に移す。今年度をめどに米国に統括会社を設立、社長には医薬事業の経験と知識を持つ外国人を採用して権限を全面的に委譲する。
2000/6/9 第一製薬
第一製薬(北京)有限公司の工場竣工 http://www.daiichipharm.co.jp/company/news055.html
June 9, 2000
Daiichi Pharmaceutical Co., Ltd. http://www.daiichipharm.co.jp/press-e/news018.html
Overview of
DPP
Name : Daiichi
Pharmaceutical (Beijing) Co., Ltd.
Tipe
of corporation : A
limited liability company
Established : May
19, 1998
Official
address : No.
5 Yong Chang Zhong Lu, Beijing Economic Technological
Development Area, Beijing, China
Representative : Atsuo
Inoue, President (Managing Director of Daiichi
Pharmaceutical Co., Ltd.)
Total
investment : US$65.5
million
Capital : US$23.8 million
Shareholders : Daiichi Pharmaceutical Co.,
Ltd. 95%
Activities : Manufacture and sale of
pharmaceuticals
Fiscal year end : December 31
Products manufactured : Cravit tablets, Translon
tablets, Tarivid tablets,Cravit injection, others
3. Overview of DPP Plant
Site : 47,800
square meters
Buildings : Building
space - 6,900 square meters
Floor
space : 11,400
square meters
Facilities : Administrative/quality control
building, solid-pharmaceutical production, injectable
pharmaceutical production, warehouse, engineering
buildings, utility facilities, others
Capacity : Solid-pharmaceuticals (film
coating tablets, plain tablets)-200 million
tablets/year
2000年9月11日
第一製薬株式会社 http://www.daiichipharm.co.jp/company/news061.html
当社は、タイ国での合弁会社ダイイチ・ファーマシューチカル(タイランド)・リミテッドの全株式を取得し、8月7日、100%子会社とするタイ国商務省への登記を完了しました。
DPTの概要は下記の通りです。
1.社名
Daiichi Pharmaceutical (Thailand)
Ltd.
2.所在地
タイ・バンコック
138, 10th Floor, Boonmitr Building
Silom Road, Bangkok 10500 Thailand
3.設立
1994年4月1日
4.資本金
10百万バーツ
5.代表取締役
Suthas Thongprasert
6.事業内容
医薬品・化成品等の輸入・販売・仲介
7.主要品目
合成抗菌剤タリビッド・クラビット、パンカル、ビタミンB6など
2003/08/29 第一製薬 http://ir.daiichipharm.co.jp/netir/TopU?event=ViewWhatsNew&itemId=105615
第一製薬 は、 (株)ディ・ディ・エス研究所 ( 医薬品副作用被害救済・研究振興調査機構 の出資事業)の成果をもとに、独創的なDDS
( Drug
Delivery System) 技術の活用により効果増強と毒性低減を可能にし、幅広い固形癌に対する画期的化学療法剤の実現を目指して、DE-310の臨床開発を欧米において進めてまいりました。
日本経済新聞 2003/8/30
同製品は 薬物を体内に効率よく送り込む薬物送達システム(DDS)技術を使った薬剤 。がん組織の血管のみを通過するため、正常組織を攻撃する可能性が低いとみていたが、米欧での臨床試験で想定していた効果が見られなかった。
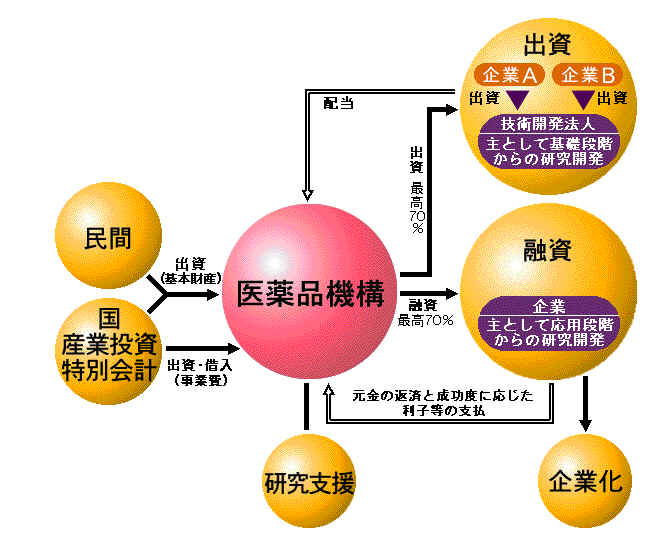
医薬品副作用被害救済・研究振興調査機構(略称:医薬品機構) http://www.kiko.go.jp/
1.名称 : 医薬品副作用被害救済・研究振興調査機構(略称:医薬品機構)
2.設立 : 昭和54年10月15日
:
(医薬品副作用被害救済基金法(昭和54年法律第55号)に基づき、「医薬品副作用被害救済基金」として設立。その後の法律改正を経て、現在の「医薬品副作用被害救済・研究振興調査機構」に至る。)
3.法人格 : 厚生労働大臣の認可を受けて設立された認可法人
4.目的 : ○ 医薬品を適正な目的のために使用したにもかかわらず発生した副作用による疾病、障害又は死亡に関して、医療費、障害年金、遺族年金等の給付を行うこと等により、医薬品の副作用による健康被害の迅速な救済を図ること。
○ 医薬品技術等に関する基礎的研究に関する業務を行い、及び民間において行われる医薬品技術等に関する試験研究の促進に関する業務を行うことにより、国民の健康の保持増進に寄与する医薬品技術等の開発を振興するとともに、医薬品等の品質、有効性及び安全性の向上に資する調査等の業務を行い、もって国民保健の向上に資すること。
業務
救済給付業務
:
医薬品副作用被害救済制度/
研究開発振興業務
研究振興業務(出資・融資等) /
調査等業務
調査指導業務/
くすりの情報
くすりの相談/
研究開発の振興 出融資
民間における医薬品、医療用具、医薬部外品、化粧品等の生産又は販売に関する技術の研究開発を促進するため、出資事業及び融資事業をはじめとして、次のような事業を行っています。
株式会社ディ・ディ・エス研究所 医薬品機構 出資先 http://www.kiko.go.jp/kenkyuu/jigyou/dds.html
(出資期間:昭和63年3月10日-平成7年3月9日)
テーマ名 : ターゲッティングDDSに関する研究開発(糖質担体等を中心とする)
代表取締役社長 : 江頭 邦雄(味の素株式会社代表取締役社長;平成12年9月現在)
医薬品機構以外の出資会社 : 旭化成工業、味の素、エーザイ、塩野義製薬、第一製薬、田辺製薬、明治製菓
2004/01/05 明治製菓/第一製薬/第一ファインケミカル
第一製薬グループの動物薬事業を明治製菓へ譲渡 http://ir.daiichipharm.co.jp/netir/TopU?event=ViewWhatsNew&itemId=106099
明治製菓は、動物薬関連事業を薬品事業の主要領域の一つとして位置付けております。
2
.明治製菓の生物産業事業本部動薬飼料部(動物薬関連)の概要
売 上 高 : 約60 億円(平成15
年3 月期)
売上構成比 : 畜水産関連(66
%)、小動物関連(5
%)、その他(29 %)
主な製品 : メイリッチ(抗生物質飼料添加剤―動物用医薬品)
3
.第一製薬の特薬部(動物薬関連)の概要
売 上 高 : 約37
億円(平成15 年3 月期)
売上構成比
: 国内畜産関連(80
%)、国内小動物関連(4
%)、輸出(16 %)
主な製品
: 動物用タリビッド(合成抗菌剤-小動物用医薬品)
4
.第一ファインケミカルの特薬部(動物薬関連)の概要
売 上 高 : 約1
億円(平成15 年3 月期)
売上構成比
: 小動物関連(100
%)
主な製品
: クリアガイドTLI
(犬トリプシン様免疫反応物質(TLI)検出用
2004/04/06 第一製薬
国内3工場の会社分割による生産新会社設立のお知らせ http://ir.daiichipharm.co.jp/netir/TopU?event=ViewWhatsNew&itemId=106191
このたび第一製薬株式会社(以下、第一製薬)は本日開催した取締役会の決議を経て、2005年4月1日付で会社分割により第一製薬の静岡工場(静岡県榛原郡金谷町)、大阪工場(大阪府高槻市)、秋田工場(秋田県秋田市)を分割し、これら3工場を統合する新たな生産会社を設立することを決定いたしましたのでお知らせいたします。
日本経済新聞 2004/4/7 改正薬事法により2005年度から、医薬品の製造と販売の分離が可能になるのに対応した。
1.生産新会社の概要
会社名 : 未定
発足年月 : 2005年4月1日(予定)
本社所在地 : 未定
工場所在地 : 静岡工場(静岡県榛原郡金谷町)、大阪工場(大阪府高槻市)、
代表者 : 未定
資本金 : 未定
従業員数 : 約560名
事業概要 : 医薬品の受託製造
主要製品 : クラビット、オムニパーク、パナルジン、アーチスト、コバシルレボフロキサシン原薬
2.親会社の概要
:
会社名 : 第一製薬株式会社
設立年月 : 1918年1月(創業1915年10月)
本社所在地 : 東京都中央区日本橋3丁目14番10号
代表者 : 取締役社長 森田清
売上高 : 3,220億円(2003年3月期連結)
従業員数 : 7,428人(2003年3月、連結ベース)
事業内容 : 医療用医薬品、一般医薬品、動物用医薬品、医療用・食添用・飼料用原末などの製造、仕入れおよび販売
2004年4月5日 第一製薬
Daiichi Medical Research, Incの営業開始について http://ir.daiichipharm.co.jp/netir/TopU?event=ViewWhatsNew&itemId=106179
第一製薬株式会社(本社:東京都中央区、社長:森田清)は、新薬の臨床開発を専門に行う子会社Daiichi
Medical Research, Inc.(DMR)を、米国ニュージャージー州に設立し、2004年4月1日より営業を開始致します。これに伴い、DMRと医薬品の販売会社に特化するDaiichi
Pharmaceutical Corporationは、米国持株会社であるDaiichi
Pharma Holdings, Inc. の傘下に入ります。
【米国子会社の概要】
1. 名称: Daiichi
Pharma Holdings, Inc.
社長 : 采孟
所在地 : ニュージャージー州モントベール
形態 : 非公開株式会社
2. 名称: Daiichi
Medical Research, Inc.
会長 : 井上敦郎
社長 : Roy E. S. Bullingham
所在地 : ニュージャージー州パークリッジ
形態 : 非公開株式会社
3. 名称: Daiichi
Pharmaceutical Corporation
社長 : James D. Hageman
所在地 : ニュージャージー州モントベール
形態 : 非公開株式会社
日刊工業新聞 2004/4/29
第一製薬はグループの構造改革を本格化する。6月に 動物薬事業を譲渡 するのに続き来年4月に 工場も分社化 し、コアに据える医療用医薬品事業の開発と営業に経営資源を集中する。
ダイイチ・メディカル・リサーチ (DMR)を中心に新薬開発体制を構築し直す。
日本経済新聞 2005/5/1
2005年11月25日 第一三共株式会社
ヘルスケア事業会社「第一三共ヘルスケア株式会社」の設立 http://www.daiichisankyo.co.jp/4less/cgi-bin/cs4view_obj.php/b_newsrelease/77/051125-001j-v1.pdf
第一三共株式会社(本社:東京、社長:庄田隆)の完全子会社である三共株式会社(本社:東京、社長:池上康弘)と第一製薬株式会社(本社:東京、社長:森田清)は、両社のヘルスケア事業の統合に向け、今般、新会社「 第一三共ヘルスケア株式会社 」を設立
いたしますので、以下のようにお知らせいたします。
商
号 第一三共ヘルスケア株式会社
取締役および監査役 代表取締役社長
井手口 盛哉(現
三共ヘルスケア事業本部長)
事業内容 医薬品、医薬部外品、化粧品、医療機器、食品、飲料水等の製造および売買
資本金 1,000万円(事業承継後、増額の予定)
2006年1月6日 第一三共 http://www.daiichisankyo.co.jp/4less/cgi-bin/cs4view_obj.php/b_newsrelease/117/060106-001j-v1.pdf
弊社の100%子会社である三共とメイワパックス並びにメイワ興産は、三共の子会社であるエフピー化工の株式に関しまして、本日、株式譲渡契約を締結いたしましたので、お知らせいたします。
日本経済新聞 2006/10/6
2007/4/23 日本経済新聞夕刊
平成19年4月23日 協和発酵工業
異動する子会社(第一ファインケミカル株式会社)の概要
平成19年4月23日 ニプロ
埼玉第一製薬株式会社の株式取得(子会社化)に関するお知らせ
当社は、このたび、第一三共株式会社(本社:
東京都中央区、社長:庄田
隆)から埼玉第一製薬株式会社の全株式を取得することについて株式譲渡契約を締結いたしましたので、下記のとおりお知らせいたします。
2. 埼玉第一製薬株式会社の概要
2008年5月21日 第一三共
欧州バイオ医薬企業U3 Pharma AG
社の買収について
当社は、この度、第一三共グループの癌及び抗体事業の強化の一環として、 U3 Pharma AG 社 (ドイツ
ミュンヘン市近郊 マーチンスリード地区
非上場企業 以下U3 社)の 全株式を取得 することで合意いたしましたのでお知らせします。
2.U3 Pharma AG 社の概要
U3-1287(抗HER-3
抗体)
・ 受容体チロシンキナーゼであるHER-3
に結合し、そのヘテロダイマーの相手となるHER-2
とEGFR(乳癌、大腸癌、肺癌等で過剰発現)の両方からのシグナル伝達を抑えるヒト抗体
・ Amgen との共同開発
・ 2008 年6 月
臨床試験開始(フェーズ1)予定
U3-1565(抗HB-EGF
抗体)
・ EGFR、HER-4
を活性化するためのリガンド(前駆体含む)を抑えるヒト抗体
・ 2009 年4Q
臨床試験開始(フェーズ1)予定
④ 従業員数 27 名
2008年6月11日 第一三共 Ranbaxy
Laboratories Limited (本社:インド共和国デリー市、ボンベイ証券取引所及びナショナル証券取引所上場。以下「Ranbaxy」)及びRanbaxyの創業家であるSingh一族(以下「創業家一族」)と、2008年6月11日、Ranbaxyの議決権総数に占める第一三共の議決権保有割合が 50.1%以上 となることを目的とする取引(以下「本取引」)に関する契約を締結いたしましたので、下記の通りお知らせいたします。
具体的には、本件実施により以下のような効果を期待しています。
・ 第一に、売上高の増大と今後の成長機会の確保です。Ranbaxyが第一三共グループに加わることにより、第一三共は「先進国市場+新興国市場」「イノベーティブ+ロングセラー」の双方を視野に入れた「複眼経営」
・ 第二に、新興市場への足がかりの獲得です。
・ 第三に、コスト競争力です。
・ 第四に、研究開発力です。
1,474億ルピー~1,980億ルピー(3,685億円~4,950億円、1ルピー=2.5円換算) となる見込みです。(公開買付けにより取得される株式数が上限に達した場合には、新株予約権は行使しない前提で算出しております。)
2005年12月期 2006年12月期 2007年12月期
売上高 53,432 61,998 74,255
経常利益 1,944 6,510 9,985
総資産 47,377 67,385 72,748
純資産 24,467 25,849 28,022
2002/9/26 日本ケミファ
ランバクシー ラボラトリーズ
リミテッドとの包括的業務提携に関するお知らせ
平成14年9月26日開催の取締役会において、ランバクシー
ラボラトリーズ
リミテッド(以下、ランバクシー社)との間で、弊社連結子会社である日本薬品工業株式会社の10%株式譲渡を含む、医薬品事業に関する業務提携を行うことを決議致しましたので、下記のとおりお知らせいたします。
日本薬品工業
19 60 一般用(薬局向)医薬品の製造販売開始
1970 日本ケミファとの業務提携により、従来の一般用医薬品に代えて医療用医薬品の製造販売を開始し、販売網を全国に拡大
1999 日本ケミファの子会社となる
2002 日本ケミファとインド、ランバクシー社との3社による包括的業務提携を締結
2005 日本ケミファとインド、ランバクシー社との合弁会社となる
2009年1月19日 第一三共 Zenotech株式の20% の公開買付けを実施するものであります。なお、手続きの進捗の状況については適宜お知らせしてまいります。
*ランバクシーが47%を保有
2009年08月07日 第一三共
---
2009 年 8 月 10 日
Zenotech Laboratories
Limited 株式に対する公開買付けの延期に関するお知らせ
Zenotech Laboratories
Limited 普通株式の取得を目的とする公開買付けについて、同日、インドの Securities Appellate Tribunal (証券上訴法廷)より本公開買付け開始の延期を要請されたことを受け、当初予定日の 8 月 11 日に本公開買付を開始しないこととなりましたのでお知らせいたします。
Zenotech's minority
shareholders complained to the Madras High Court that Daiichi
Sankyo's offer to pay 113.62 Indian rupees per share was too
low and that they would seek 160 rupees per share, India's
Economic Times reported on Wednesday . Zenotech shares closed
on Tuesday at 105.40 rupees. Daiichi Sankyo shares edged up
0.7 percent to 1,685 yen on Wednesday.
2010/8/4
Zenotech Laboratories Limited株式に対する公開買付けの開始に関するお知らせ
今般、インド共和国の法令・ルールに則り、本公開買付けを開始することとなりましたので、下記の通り
お知らせいたします。
本公開買付けの概要
(1)
買付け等の期間(予定)
2010/9/15
本公開買付けが終了いたしましたので、下記のとおり本公開買付けの結果についてお知らせいたします。 6,886,500 株( 20 %) 6,886,500 株( 20 %) 782 百万ルピー( 1,565 百万円、 1 ルピー 2.0 円換算)
2010 年2 月26 日 第一三共
「第一三共エスファ株式会社」設立について バイオシミラー ( バイオ医薬品の後発品 )への取り組みも、グループ全体で検討していきます。
ジェネリック医薬品メーカー
2011年3月 1日
米国Plexxikon Inc.の買収について
第一三共株式会社(本社:東京都中央区、以下「当社」)は、この度、当社グループの癌事業強化の一環として、Plexxikon社(本社:米国カリフォルニア州バークレー、非上場企業、以下「PLX社」)の全株式を取得することで合意いたしましたのでお知らせします。
1.本買収の概要と意義
・癌領域において画期的な治療薬を提供することは、当社の中長期な目標の一つであります。本買収により、第一三共グループは、日本、米国、欧州、イ
ンドにおいて自社の探索研究拠点を有することとなります。今後はそれぞれの特長を活かしたグローバルな研究活動を推進することで、更なる機能強化を図り、
ファーストインクラスの創薬につなげていきます。
・PLX社は、優れた創薬プラットフォームであるScaffold-Based
Drug Discovery TM
Platform * を有しており、当社との連携のもと、有望な新薬を創出していきます。
*様々な創薬ターゲットに対して、効率的にリード化合物を創製する技術
・PLX社が創製し、ロシュ社と共同開発している悪性黒色腫治療薬(PLX4032、現在第Ⅲ相試験実施中)の米国におけるコ・プロモーション権については、今回の買収により、当社、米国子会社である第一三共INC.(本社:ニュージャージー州、以下「DSI」)が行使し、承認取得後は、DSIがロシュグループのジェネンテック社との共同販促活動を行う予定です。
・PLX社は、PLX4032以外にも多くのキナーゼ阻害剤を有しており、PLX3397、PLX5622については、臨床試験が実施されています。
・買収対価として、買収完了時に805百万米ドルを支払い、その後、PLX4032の上市時に追加で最大130百万米ドルの支払を予定しております。これらは全額自己資金で対応する予定です。
2.PLX社の概要
①沿 革
②主要研究開発領域
③主要開発品
④従業員数 約45名
⑤主要提携先 ロシュ社/ジェネンテック社
⑥拠 点
2013/2/14 第一三共
独自技術を用いたデュシェンヌ型筋ジストロフィー核酸医薬の開発についてOrphan Disease
Treatment Institute )を設立し、当該新会社と共同で、第一三共の独自技術を用いた修飾核酸であるENA®オリゴヌクレオチド(*)を有効成分とするデュシェンヌ型筋ジストロフィー ( Duchenne
muscular dystrophy 、DMD)治療剤の開発に着手することを決定しましたので、お知らせいたします。POC(Proof
of Concept:新しい概念や理論、原理などが実現可能であることを示すための簡易な試行 )取得を目的とする共同開発を実施します。
米国におけるオルメサルタン製造物責任訴訟の和解に向けた合意について
第一三共と米国子会社であるDaiichi Sankyo,
Incは、米国において高血圧症治療剤オルメサルタンの服用によりスプルー様腸疾患(重症下痢等を主な症状とする疾患)等が発現したと主張する原告から2014年1月以降提起されている製造物責任訴訟に関し、訴訟手続を進めてまいりましたが、今般、和解に向けた合意に至りましたので、お知らせいたします。
本和解合意は、本訴訟における原告(約2,300名)および一定の基準を満たす未提訴者の95%が和解への参加を表明した場合に有効となり、その後、3億米ドルが和解基金 に支払われ、本和解合意の対象者は和解基金から支払いを受けます。和解基金の3億米ドルは、原告側弁護士費用および和解手続に関する諸経費を含みます。
なお、和解基金に支払われる3億米ドルの大半は保険による填補 が見込まれており、損益への重要な影響はありません。
当社は、本訴訟における法的責任を認めるものではありませんが、本和解により早期解決を図ることが最善と判断し、それにより世界中の患者さんのために革新的な治療薬の開発に一層注力してまいります。
当社は、患者さんの安全を第一に、オルメサルタンの臨床試験データおよび製造販売後の症例報告データを継続的に評価、分析することで潜在的な安全性上の懸念がないことを確認し、引き続き世界中の高血圧症の患者さんのためにオルメサルタンを提供してまいります。
オルメサルタンについて
オルメサルタンは、高血圧症治療の適応で承認されたアンジオテンシンII受容体拮抗薬で、単剤または配合剤として服用されています。
2016/5/10 第一三共、 Ranbaxy
Laboratories の元株主を相手とする仲裁裁判所の判断を発表
Daiichi Wins
$550 Million Award Enforcement Case in India
Malvinder Singh and
Shivinder Singh must pay Daiichi Sankyo Co. 35 billion
rupees ($550 million )
awarded in an arbitration over the sale of a drugmaker
controlled by the brothers, an Indian court ruled.
The verdict was
pronounced by a single-judge bench of Justice Jayant
Nath of the Delhi High Court
on Wednesday. He rejected all objections raised
by the Singh brothers and said the arbitration award is
in line with Indian laws and policy. The ruling
can
still be appealed in a two-member panel of the Delhi
High Court or the Supreme Court.
The Japanese
drugmaker had sought the intervention of India’s courts
to enforce an award by a Singapore
tribunal which found the
Singh brothers concealed critical information
during the sale of their generic drug firm,
Ranbaxy Laboratories Ltd. ,
to Daiichi in 2008. The brothers contested that ruling
in Singapore court and had also opposed implementation
of the award in India.
As the case proceeded
Daiichi sought injunctions preventing the Singh brothers
from selling assets to ensure the brothers have the
funds to fulfill their potential liability. India’s top
court has ordered the brothers not to sell or dilute
their shareholding in Fortis Healthcare Ltd., India’s
second-largest private hospital chain, until it decides
on Daiichi’s petition to place a longer-term halt on
asset sales by the brothers.
Shares of Religare
Enterprises Ltd., also controlled by the brothers, fell
4.3 percent to 43.20 rupees, their lowest level since
Nov. 14, in Mumbai on Wednesday, while Fortis Healthcare
declined 5.3 percent. The benchmark S&P BSE Sensex
dropped 0.2 percent.
Award
Implementation The court said
Daiichi can claim the amount from the Singh brothers and
their companies but not from their children, who were
also named in the suit filed by Daiichi.
“We are disappointed
with the ruling,” a spokesman for RHC Holding Pvt., the
Singh brothers’ main holding company, said in an emailed
statement. Further course of action will be decided
after studying the order in detail, he said. The court’s
decision that the award won’t be enforceable against the
children was a “partial success,” the spokesman said.
Daiichi will now file
an application with the court seeking execution of the
award with steps such as the sale of shares and assets
held by companies controlled by the Singh brothers
including Fortis and Religare, Amit Mishra of P&A Law
Office, a firm representing the Japanese company, said
in a statement.
The brothers have
been under pressure to sell assets to deal with debt at
RHC Holding. The credit rating on RHC’s long-term
non-convertible debt was downgraded to “default” by
India Ratings & Research in July after RHC missed
scheduled coupon payments on its non-convertible
debentures the previous month and reflects the group’s
impaired ability to service debt, according to the
agency.
The genesis of the
brothers’ battle with Daiichi is the sale of Ranbaxy for
$4.6 billion, which took place just months before the
U.S. Food and Drug Administration banned imports at two
of the generic drugmaker’s Indian plants. That same year
the U.S. Department of Justice launched a probe,
eventually resulting in a guilty plea by Ranbaxy and a
$500 million settlement for selling adulterated drugs.
The Singhs were not named in the Ranbaxy probe.
In 2012, Daiichi
filed a case with an International Court of Arbitration
in Singapore accusing the Singhs of concealing and
misrepresenting critical information about the U.S.
probes into Ranbaxy. In 2016 the tribunal decided the
Singhs should pay Daiichi both damages and interest.
2020年7月27日 第一三共
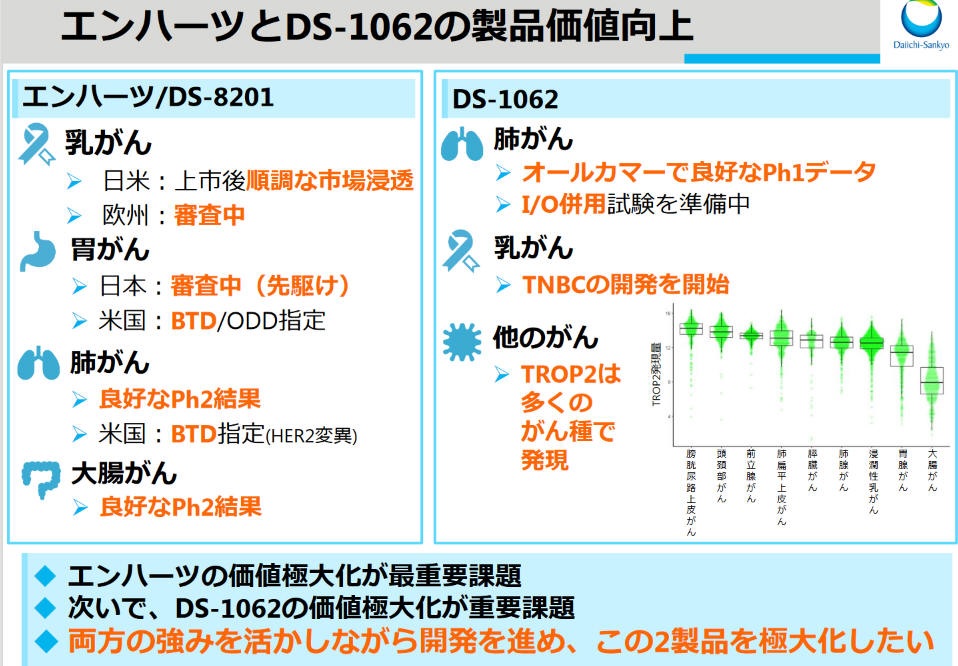
DS-1062に関するアストラゼネカとのグローバル開発及び販売提携のお知らせ
第一三共は、当社が保有するDS-1062(TROP2に対する抗体薬物複合体(ADC))について、グローバルな開発及び商業化契約をアストラゼネカと締結しましたので、お知らせいたします。
TROP2 は、肺がんを含む様々ながん細胞の細胞膜上に過剰発現し、がん細胞の増殖促進、転移、薬剤への耐性獲得等に関与することが知られています。
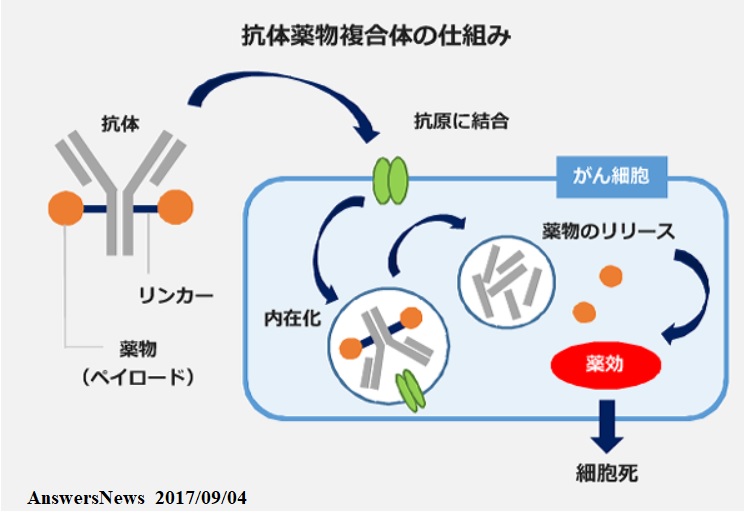
DS-1062は、がん細胞膜上のTROP2に結合して細胞内に取り込まれた後、薬物部分がリンカーから切り離され、トポイソメラーゼⅠを阻害することによる殺細胞効果が期待されています。
ADCは低分子医薬品(薬物)と抗体医薬を組み合わせた複合体で、抗体が「運び役」となることでがん細胞の中まで届き、その後に「攻撃役」の低分子医薬品が、がん細胞をたたく。
ADCは低分子医薬品(薬物)と抗体医薬を組み合わせた複合体で、抗体が「運び役」となることでがん細胞の中まで届き、その後に「攻撃役」の低分子医薬品が、がん細胞をたたく。
ADCは低分子医薬品(薬物)と抗体医薬を組み合わせた複合体で、抗体が「運び役」となることでがん細胞の中まで届き、その後に「攻撃役」の低分子医薬品が、がん細胞をたたく。
ADCは低分子医薬品(薬物)と抗体医薬を組み合わせた複合体で、抗体が「運び役」となることでがん細胞をたたく。
当社とアストラゼネカは、全世界(当社が独占的権利を有する日本は除く)において、本剤の単剤療法及び併用療法を共同で開発し、商業化します。当社は本剤の製造及び供給を担います。
本契約は、当社のADCにおいて、エンハーツ®に続く2つ目のアストラゼネカとのグローバル提携となります。
第一三共は2020年3月25日、抗悪性腫瘍剤「エンハーツ® 点滴静注用
100mg」(一般名:トラスツズマブ デルクステカン(遺伝子組換え)、HER2に対する抗体薬物複合体 (ADC))について、本日、「化学療法歴のあるHER2陽性の手術不能又は再発乳癌(標準的な治療が困難な場合に限る)」を適応として、国内製造販売承認を取得しましたので、お知らせいたします。
第一三共は2019年3月29日、開発中の抗HER2抗体薬物複合体(ADC)トラスツズマブ デルクステカン(「DS-8201 」)について、英アストラゼネカとグローバルな開発・販売提携を結んだと発表した。第一三共が提携の対価として受け取る金銭は、契約一時金1485億円を含め、最大で総額7590億円。
HER2陽性の乳がんについて
2019/4/1 第一三共、抗がん剤で AstraZeneca と戦略的提携、最大で69億ドル受領
米ワイス(後に米ファイザーが買収)が00年に白血病薬「マイロターグ」を先んじて発売した。しかしマイロターグは副作用が頻出し、米国では一時販売が中止された。
現在、国内で流通しているADCはこのマイロターグに加え、スイス・ロシュ(日本では中外製薬が販売)の乳がん薬「カドサイラ」、米シアトル・ジェネティクスと武田薬品工業が共同開発した悪性リンパ腫薬「アドセトリス」、そしてファイザーの白血病薬「ベスポンサ」という4品だ。
ADCについて:
米Wyeth (後にPfizerが買収)が2000年に白血病薬「マイロターグ:Mylotarg」を先んじて発売した。しかしマイロターグは副作用が頻出し、米国では一時販売が中止された。Seattle
Genetic
本契約の下、当社はアストラゼネカから10億米ドルの契約時一時金を受け取ります(本契約締結時に3.5億米ドル、その1年後に3.25億米ドル、その2年後に3.25億米ドル)。
本剤の全世界(当社が独占的権利を有する日本は除く)における利益と開発・販売等費用は、両社で折半します。
本剤の売上収益は、日本、米国、当社が拠点を有する欧州及びその他地域の複数国においては当社が計上し、中国、オーストラリア、カナダ、ロシア及びその他地域においてはアストラゼネカが計上します。